YAP1抑制誘導(dǎo)前列腺癌相關(guān)成纖維細(xì)胞表型轉(zhuǎn)換為腫瘤抑制
前列腺癌很少對免疫檢查點阻斷(ICB)治療有反應(yīng)。癌癥相關(guān)成纖維細(xì)胞(CAF)是免疫“冷”腫瘤微環(huán)境的關(guān)鍵組成部分,被認(rèn)為是增強(qiáng)免疫治療反應(yīng)的有希望的靶點。在本研究中,作者旨在揭示調(diào)節(jié)CAF可塑性的機(jī)制,以確定將CAF從致蛋白表型轉(zhuǎn)變?yōu)榭鼓[瘤表型的潛在策略,并增強(qiáng)ICB在前列腺癌中的療效。整合四個前列腺癌單細(xì)胞RNA測序數(shù)據(jù)集定義了致蛋白和抗腫瘤的CAF, RNA-seq、流式細(xì)胞術(shù)和前列腺癌類器官模型證明了兩種CAF亞型的功能。細(xì)胞外基質(zhì)相關(guān)的CAFs (ECM-CAF)促進(jìn)膠原沉積和癌細(xì)胞進(jìn)展,淋巴細(xì)胞相關(guān)的CAFs (Lym-CAF)表現(xiàn)出抗腫瘤表型并誘導(dǎo)CD8+ T細(xì)胞的浸潤和活化。YAP1活性調(diào)節(jié)ECM-CAF表型,YAP1沉默促進(jìn)向lym - caf的轉(zhuǎn)換。NF-κB p65是Lym-CAF亞群的核心轉(zhuǎn)錄因子,YAP1抑制p65的核易位。體內(nèi)ECM-CAFs中選擇性缺失YAP1可促進(jìn)CD8+ t細(xì)胞浸潤活化,增強(qiáng)抗PD-1治療前列腺癌的治療效果。總的來說,本研究揭示了前列腺癌中調(diào)節(jié)CAF身份的機(jī)制,并強(qiáng)調(diào)了改變CAF亞型以抑制腫瘤生長和增加對ICB敏感性的治療策略。該文章于2024年 月發(fā)表于《Cancer Research》,IF:12.5。
摘要圖:
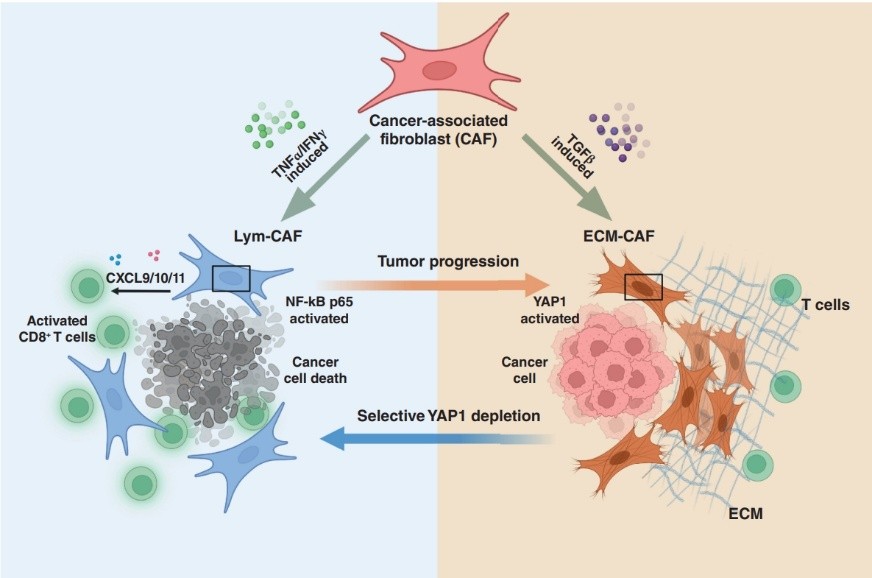
主要研究結(jié)果:
1. 前列腺癌中ECM-CAF和Lym-CAF的鑒定
作者通過結(jié)合來自33例患者的37例前列腺癌樣本的scRNA-seq數(shù)據(jù)集,研究了前列腺癌TME的免疫抑制性質(zhì)(圖1A)。進(jìn)一步分析顯示,這些caf被分成6個簇(圖1B)。作者進(jìn)行了差異基因表達(dá)分析,并確定了每種CAF亞型的特征標(biāo)記(圖1C)。作者通過Gene Ontology分析研究了6個簇之間CAF功能的差異,發(fā)現(xiàn)兩個簇具有不同的功能:c3CAFs與膠原纖維組織高度相關(guān),c5CAFs與白細(xì)胞遷移和炎癥反應(yīng)調(diào)節(jié)相關(guān)(圖1D)。作者進(jìn)一步研究了這兩種亞型,通過FACS從人前列腺癌中分離c3CAFs與特征標(biāo)記CD248(也稱為內(nèi)毒素)和c5CAFs與標(biāo)記TSG6[腫瘤壞死因子α誘導(dǎo)蛋白6 (TNFAIP6)],并進(jìn)行RNA-seq分析(圖1E)。這些分析表明,c3CAFs在CD248、I型膠原α 1鏈(COL1A1)、COL1A2、鈣鈣蛋白1 (CNN1)和細(xì)胞通信網(wǎng)絡(luò)因子2 (CCN2)中高度富集,而c5CAFs在TNFAIP6、IL33、CXCL8、CXCL9、CXCL10和CXCL11中高度富集(圖1F)。基于它們的功能和特征基因,作者將c3CAFs命名為“ecm相關(guān)CAF”(ECM-CAF),將c5CAFs命名為“淋巴細(xì)胞相關(guān)CAF”(Lym-CAF)。
通過對RNA-seq數(shù)據(jù)的基因本體分析,比較了ECM-CAF和Lym-CAF的主要功能。作者發(fā)現(xiàn)ECM- caf與ECM組織相關(guān),而Lym-CAF與免疫反應(yīng)和白細(xì)胞活化相關(guān),這與scRNA-seq數(shù)據(jù)庫結(jié)果一致(圖1G和H)。作者試圖通過豐富每個亞型的通路來深入了解ECM- caf和Lym-CAF是如何被誘導(dǎo)的。基因集富集分析結(jié)果表明,ECM-CAF富集于tgf -β信號通路,而Lym-CAF富集于tnf -α和ifn -γ信號通路(Supplementary Fig. S1I和S1J)。作者推測ECM-CAF是由TGFβ刺激誘導(dǎo)的,而Lym-CAF是由TNFα/IFNγ聯(lián)合刺激誘導(dǎo)的。因此,作者從前列腺癌患者身上分離出人原代caf,在外源細(xì)胞因子的培養(yǎng)基中培養(yǎng)48小時,作者使用定量PCR檢測ECM-CAF和Lym-CAF的特征標(biāo)記。結(jié)果證實,TGFβ刺激增加了ECM-CAF相關(guān)標(biāo)志物的表達(dá),因此作者稱之為“誘導(dǎo)ECM-CAF”(i-ECM-CAF)。TNFα/IFNγ刺激增加了Lym-CAF相關(guān)標(biāo)志物的表達(dá),作者稱之為“誘導(dǎo)Lym-CAF”(i-Lym-CAF;圖1I和J)。這些結(jié)果揭示了ECM-CAF和Lym-CAF的功能,并鑒定了它們各自的特征標(biāo)記。
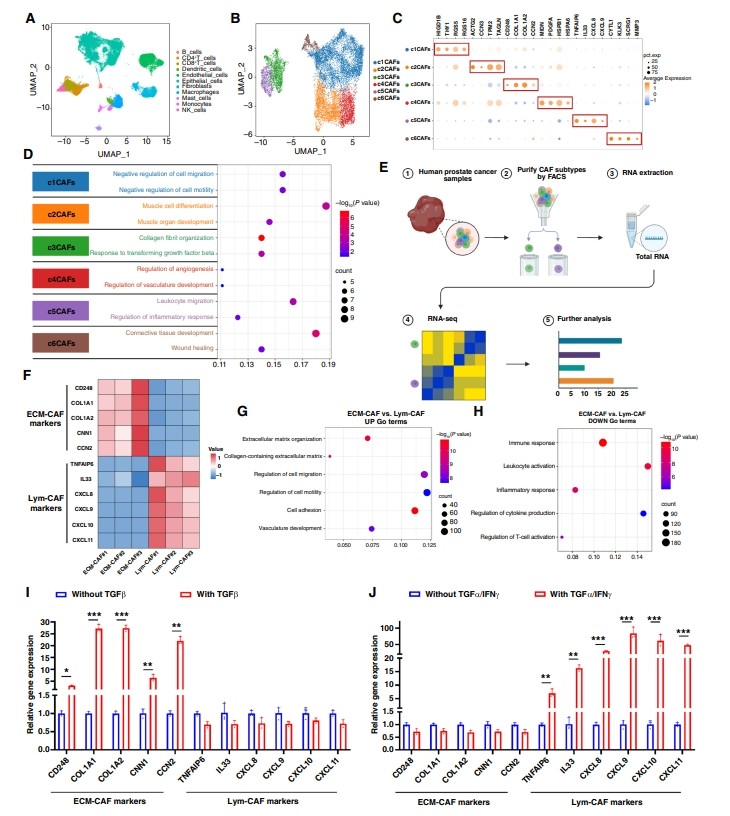
圖1 前列腺癌中ECM-CAF和Lym-CAF的鑒定
2. Lym-CAF通過NF-κB p65信號通路促進(jìn)CD8+ T細(xì)胞的活化
為了驗證ECM-CAF和Lym-CAF在體內(nèi)的功能,作者設(shè)計了一個腫瘤同源移植實驗,將RM-1和預(yù)誘導(dǎo)的caf共注射(圖2A)。首先,作者分離小鼠前列腺基質(zhì)細(xì)胞,并在TGFβ或TNFα/IFNγ刺激下培養(yǎng),以誘導(dǎo)ECM-CAF或lim - caf表型。然后,作者將前列腺癌細(xì)胞RM-1混合預(yù)誘導(dǎo)的cas皮下植入腫瘤同種移植物。值得注意的是,這兩種CAF亞型表現(xiàn)出相反的生物學(xué)效應(yīng)。RM-1細(xì)胞與i-ECM-CAF混合可顯著促進(jìn)前列腺癌的生長。然而,與對照CAF相比,i-Lym-CAF抑制腫瘤生長(圖2B和C)。作者使用流式細(xì)胞術(shù)檢測CD8+ T細(xì)胞的浸潤情況,并評估CD25、CD69、顆粒酶B(Gra B)和IFNγ對CD8+ T細(xì)胞的激活作用。結(jié)果顯示,i-Lym-CAF增加了CD8+ T細(xì)胞的浸潤和活化(圖2D-H)。作者進(jìn)一步分析了Lym-CAF在TCGA數(shù)據(jù)集中的臨床意義。結(jié)果強(qiáng)調(diào),較高的Lym-CAF比例產(chǎn)生較高的ESTIMATE免疫評分,無進(jìn)展間期生存分析證實,較高的Lym-CAF比例與較好的預(yù)后相關(guān)。
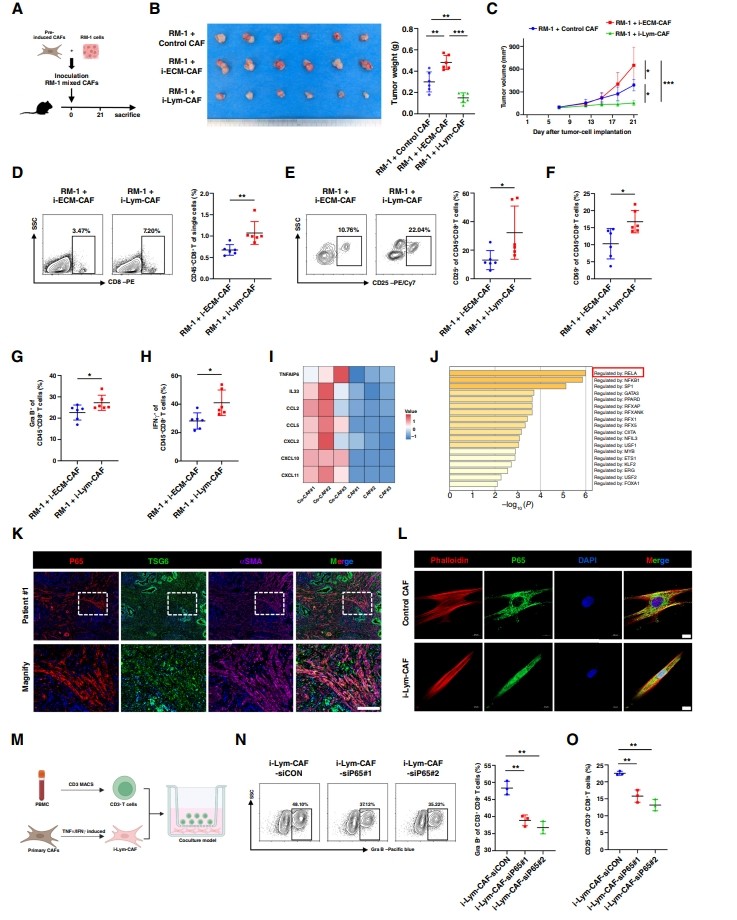
圖2 Lym-CAF通過NF-κB p65信號通路促進(jìn)CD8+ T細(xì)胞的活化
TNFα和IFNγ主要由TME中的免疫細(xì)胞分泌。因此,作者將CAFs與從人PBMCs中獲得的CD3+淋巴細(xì)胞共培養(yǎng)。共培養(yǎng)/不共培養(yǎng)48小時后,收集CAFs并進(jìn)行RNA-seq分析。結(jié)果顯示,與CD3+淋巴細(xì)胞共培養(yǎng)后,Lym-CAF的特征標(biāo)記物TNFAIP6、IL33、CXCL10和CXCL11上調(diào),表明誘導(dǎo)了Lym-CAF表型(圖2I)。基因本體分析表明,與CD3+淋巴細(xì)胞共培養(yǎng)后,CAFs的免疫應(yīng)答功能得到增強(qiáng)。為了研究Lym-CAF誘導(dǎo)的機(jī)制,作者使用了轉(zhuǎn)錄因子富集分析。作者發(fā)現(xiàn),在與CD3+淋巴細(xì)胞共培養(yǎng)后,RELA (NF-κB p65)是lim - caf中表達(dá)上調(diào)最強(qiáng)烈的轉(zhuǎn)錄因子(圖2J)。同樣,scRNA-seq數(shù)據(jù)表明,RELA在Lym-CAF中特異性高表達(dá)。因此,作者通過免疫熒光染色檢測了Lym-CAF在人前列腺癌病理切片中的特征,結(jié)果顯示TSG6、p65和αSMA具有良好的共定位(圖2K)。此外,作者驗證了p65的核易位,作者的結(jié)果表明p65在i-Lym-CAF中被激活(圖2L),這表明Lym-CAF通過NF-κB p65信號通路對CD8+ T細(xì)胞發(fā)揮激活作用。
在將i- lim - caf與CD3+淋巴細(xì)胞共培養(yǎng)之前,作者使用siRNA敲低p65在i-lim-caf中的表達(dá)。作者評估了p65在i-Lym-CAF中的敲除效率,并檢測了CD3+淋巴細(xì)胞中的p65,以排除無意的沉默。共培養(yǎng)48h后,收集CD3+淋巴細(xì)胞,流式細(xì)胞術(shù)分析。作者評估了Gra B和CD25對CD8+ T細(xì)胞的激活作用,結(jié)果表明p65對Lym-CAF具有免疫激活作用(圖2M-O)。作者還使用定量PCR檢測了CXCL9/10/11在i-Lym-CAF中的表達(dá),結(jié)果表明NF-κB p65對CXCL9/10/11的分泌至關(guān)重要。基于這些結(jié)果,作者證實了Lym-CAF具有抗腫瘤表型,并可能通過NF-κB p65信號通路激活CD8+ T細(xì)胞。
3. ECM-CAF促進(jìn)膠原沉積和癌細(xì)胞進(jìn)展
據(jù)報道,CAF對膠原和ECM的過度分泌和沉積有助于免疫上的“冷”TME。作者的研究同樣揭示并鑒定了一種具有ECM組織特征的CAF亞型,ECM-CAF。如上所述,RM-1細(xì)胞與i-ECM-CAF混合可顯著促進(jìn)前列腺癌的生長。因此,作者進(jìn)一步證明ECM-CAF通過馬松染色和原子力顯微鏡(AFM;圖3A和B)。TCGA數(shù)據(jù)集分析顯示,ECM-CAF與ecm評分呈高度正相關(guān),無進(jìn)展間期生存分析顯示,ECM-CAF比例高預(yù)后較差。同樣,scRNA-seq數(shù)據(jù)表明,ECM-CAF高度表達(dá)ecm相關(guān)基因。
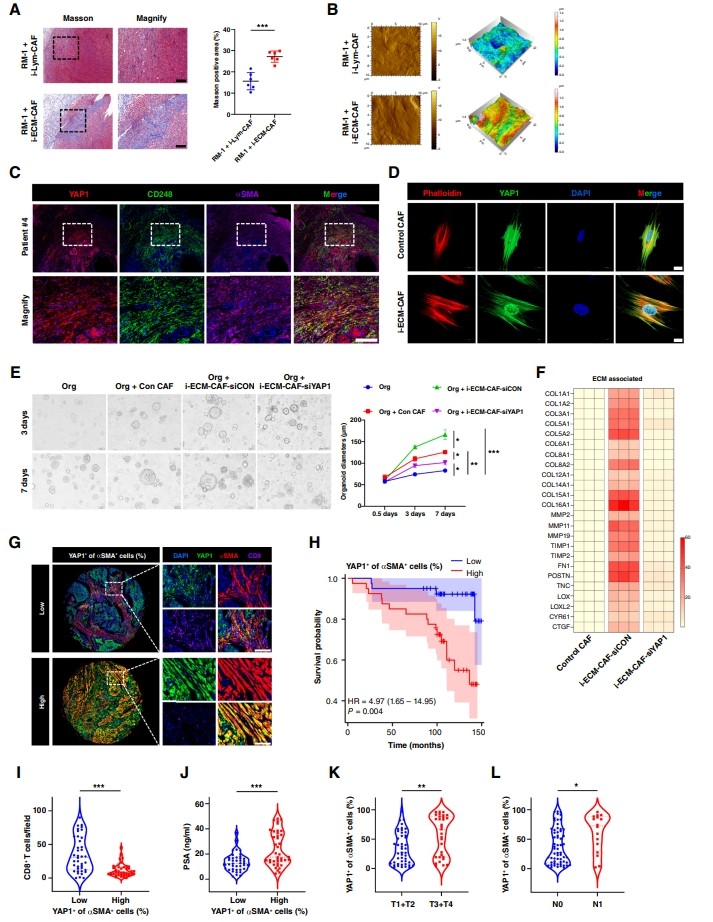
圖3 ECM-CAF促進(jìn)膠原沉積和癌細(xì)胞進(jìn)展
據(jù)報道,YAP1對肝星狀細(xì)胞激活具有轉(zhuǎn)錄控制作用。肝星狀細(xì)胞的活化引起纖維生成,促進(jìn)ecm相關(guān)基因的表達(dá),一定程度上表現(xiàn)出ECM-CAF表型。因此,作者研究了YAP1在前列腺癌ECM-CAF中的作用及其機(jī)制。首先,scRNA-seq數(shù)據(jù)表明,YAP1在ECM-CAF中高表達(dá)。同樣,作者通過免疫熒光染色檢測了人類前列腺癌標(biāo)本病理切片中的ECM-CAF特征,結(jié)果顯示CD248、YAP1和αSMA具有良好的共定位(圖3C)。其次,作者驗證了YAP1的核易位,結(jié)果表明YAP1在i-ECM-CAF中被激活(圖3D)。此外,作者通過分離和培養(yǎng)前列腺癌類器官來評估YAP1在體外ECM-CAF中的功能。作者將類器官與人誘導(dǎo)的ECM-CAF共培養(yǎng),并證明caf,特別是i-ECM-CAF,顯著促進(jìn)了類器官的生長。值得注意的是,i-ECM-CAF增強(qiáng)了促瘤作用,而YAP1敲低逆轉(zhuǎn)了i-ECM-CAF的促瘤作用(圖3E)。作者還通過定量PCR研究了caf中ecm相關(guān)基因,發(fā)現(xiàn)YAP1沉默顯著抑制了ecm相關(guān)基因,表明YAP1在ECM-CAF中發(fā)揮了ecm高分泌功能(圖3F)。
作者利用前列腺癌患者的TMA進(jìn)行多重免疫組化染色,探討YAP1高表達(dá)在CAFs中的臨床意義。結(jié)果表明,αSMA+ CAFs中YAP1高表達(dá)的患者總體生存預(yù)后較差,CD8+ T細(xì)胞浸潤較低(圖3G和H)。此外,αSMA+ CAFs中YAP1高表達(dá)的患者T分期、N分期、腫瘤分級和前列腺特異性抗原濃度較高(圖3I-L),提示cas中的YAP1是一個具有臨床意義的靶點。
4. YAP1是Lym-CAF和ECM-CAF之間交換的媒介
由于CAF具有吸引力的可塑性,作者研究了兩種CAF亞型之間的聯(lián)系。首先,作者對這六個CAF簇進(jìn)行了偽時間分析,發(fā)現(xiàn)Lym-CAF可以分化為ECM-CAF。然后,作者分析了ECM-CAF和Lym-CAF的偽時間軌跡,作者的結(jié)果證實了這一軌跡,并表明YAP1的軌跡與ECM-CAF的轉(zhuǎn)化是一致的,這表明YAP1是調(diào)節(jié)這兩種CAF亞型之間轉(zhuǎn)換的看門人(圖4A)。
作者通過在預(yù)誘導(dǎo)的Lym-CAF中過表達(dá)組成性激活的YAP1S127A或沉默YAP1,證明了YAP1在這種轉(zhuǎn)化中的作用。正如預(yù)期的那樣,當(dāng)YAP1過表達(dá)時,ECM-CAF表型增強(qiáng),而YAP1在i-Lym-CAF中沉默時,Lym-CAF表型增強(qiáng)(圖4B和C)。為了將ECM-CAF轉(zhuǎn)化為Lym-CAF,作者在與CD3+ T細(xì)胞共培養(yǎng)之前,在預(yù)誘導(dǎo)的ECM-CAF中使用siRNA敲低YAP1。結(jié)果顯示,YAP1在ECM-CAF中的沉默增加了lym-caf相關(guān)標(biāo)記物的表達(dá),最重要的是,增強(qiáng)了CD8+ T細(xì)胞的活化(圖4D-F)。此外,作者通過ELISA驗證了CXCL9/10/11的分泌,結(jié)果表明YAP1的缺失促進(jìn)了CXCL9/10/11的分泌,這意味著在ECM-CAF中靶向YAP1的缺失可能促進(jìn)T細(xì)胞的活化。
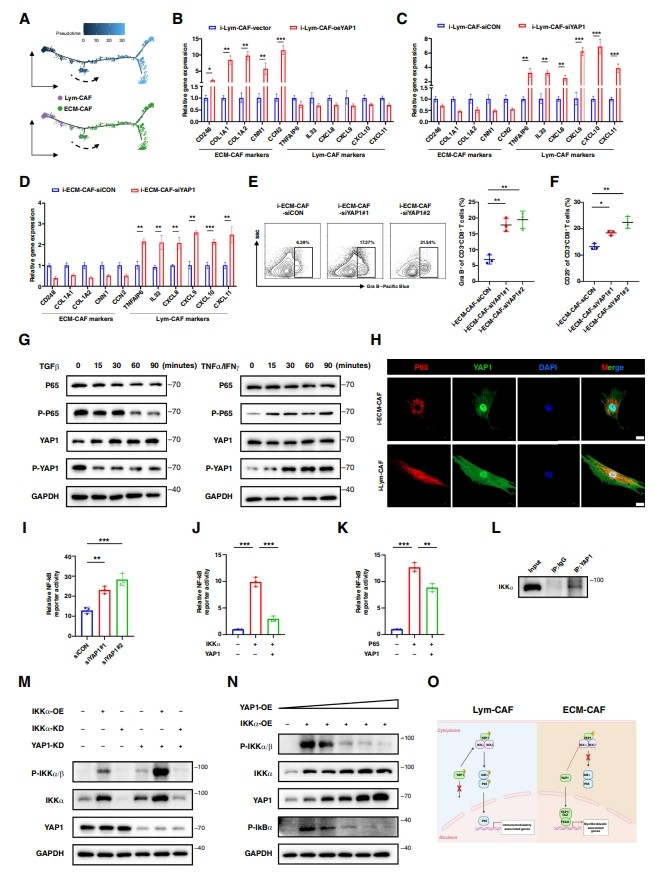
圖4 YAP1是Lym-CAF和ECM-CAF之間切換的看門人
作者進(jìn)一步研究了ECM-CAF和Lym-CAF表型轉(zhuǎn)換的分子機(jī)制,YAP1和NF-κB p65分別是核心轉(zhuǎn)錄因子。作者檢測了在TGFβ或TNFα/IFNγ刺激下YAP1和p65及其磷酸化形式。Western blotting和免疫熒光分析證實,在ECM-和Lym-CAF表型中,YAP1和p65在核易位方面是互斥的,并且分別占主導(dǎo)地位(圖4G和H)。作者還注意到,通過雙熒光素酶報告基因檢測,YAP1沉默后,NF-κ b啟動子的激活程度更高(圖4I),這表明YAP1抑制NF-κ b途徑的激活。為了進(jìn)一步研究YAP1與NF-κB p65上游的經(jīng)典抑制劑核因子κB激酶α (IKKα)的相互作用,作者檢測了IKKα抑制劑。結(jié)果顯示,YAP1顯著抑制IKKα激活的NF-κB活性,表明YAP1可能通過抑制IKKα而不是直接抑制p65起作用(圖4J和K)。因此,作者使用原代CAFs進(jìn)行共免疫沉淀,結(jié)果顯示YAP1可以直接結(jié)合IKKα(圖4L)。YAP1敲低顯著激活磷酸化ikk α/β。值得注意的是,YAP1的梯度過表達(dá)也減弱了磷酸化ikk α/β的表達(dá)。此外,磷酸化i -κ b被下調(diào),使p65不會與i - κ b復(fù)合物分離,從而抑制核易位(圖4M和N)。這些結(jié)果表明,YAP1通過與IKKα的直接相互作用抑制NF-κB p65的活化,抑制IKKα的磷酸化。因此,作者證明了YAP1是Lym-CAF和ECM-CAF之間切換的媒介(圖4O)。
5. 靶向ECM-CAF的選擇性YAP1缺失在體內(nèi)可抑制腫瘤進(jìn)展
接下來,作者證明了靶向ECM-CAF的選擇性YAP1缺失可以在體內(nèi)將ECM-CAF表型轉(zhuǎn)換為抗腫瘤Lym-CAF。首先,作者選擇CD248作為ECM-CAF的特征標(biāo)記物,構(gòu)建CD248 - creert2;Rosa26-LSL-tdTomato小鼠評價CD248的特異性。作者通過免疫熒光染色驗證了CD248與COL1A1和αSMA的良好共定位,這表明CD248是特異性表達(dá)的,是ECM-CAF的潛在靶點。此外,作者構(gòu)建了Cd248-CreERT2;Yap1flox/flox (cKO)小鼠,作者可以使用它莫西芬在ECM-CAF中實現(xiàn)選擇性的YAP1消耗(圖5A)。植入RM-1腫瘤同基因移植物后,作者發(fā)現(xiàn)靶向ECM-CAF的選擇性YAP1缺失抑制了前列腺癌的進(jìn)展(圖5B和C)。流式細(xì)胞術(shù)分析顯示CD8+ T細(xì)胞的浸潤增加(圖5D)。作者還觀察到,衰竭標(biāo)志物PD-1和CTLA4在cKO小鼠中減少(圖5E)。同時,活化的標(biāo)記物CD25、CD69、Gra B和IFNγ上調(diào)(圖5F和G),這意味著ECM-CAF中YAP1的選擇性缺失具有強(qiáng)大的腫瘤抑制作用,可以激活CD8+ T細(xì)胞的抗腫瘤功能。此外,作者進(jìn)行了Masson染色和原子力顯微鏡形態(tài)作圖,發(fā)現(xiàn)在選擇性去除YAP1后,前列腺癌中的膠原沉積減少(圖5H和I)。作者還在Cd248-CreERT2上植入了trump - c1腫瘤同基因移植物;Yap1flox/flox小鼠,結(jié)果表明,在ECM-CAF中選擇性地缺失YAP1增加了CD8+ T細(xì)胞的浸潤和活化,并表現(xiàn)出腫瘤抑制作用。為了排除他莫昔芬引起的免疫改變,作者分別用載體或他莫昔芬治療Cd248-CreERT2小鼠。結(jié)果顯示,他莫昔芬治療后無明顯變化。
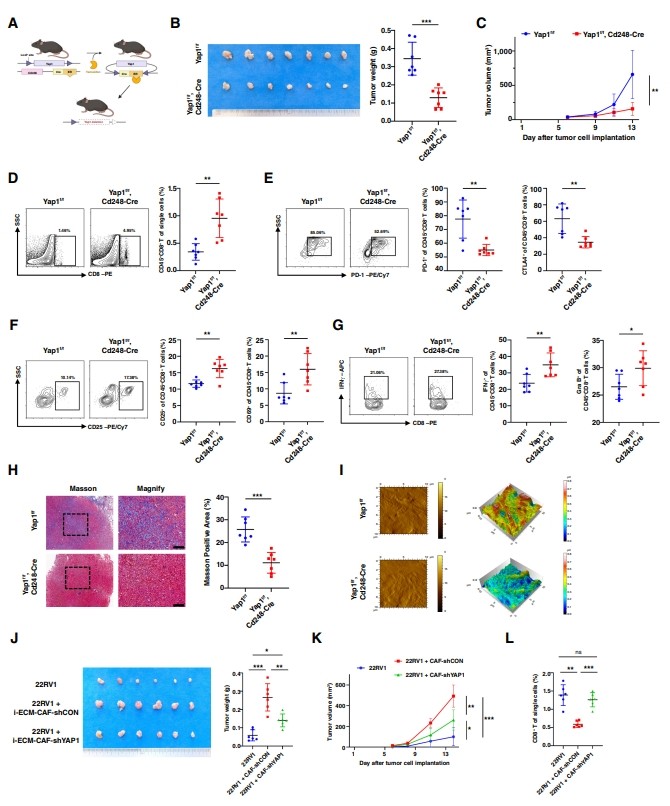
圖5 靶向ECM-CAF的選擇性YAP1缺失在體內(nèi)可抑制腫瘤進(jìn)展
作者還在NCG小鼠上建立了人源化免疫重建模型,以徹底驗證ca -選擇性YAP1缺失的腫瘤抑制作用。如前所述,將免疫缺陷的NCG小鼠植入預(yù)激活的人pbmc。此外,作者將22Rv1細(xì)胞系與人原代預(yù)誘導(dǎo)的ECM-CAF混合使用,發(fā)現(xiàn)與上述動物模型一樣,敲低ECM-CAF中的YAP1可以抑制腫瘤進(jìn)展(圖5J和K),并增加CD8+ T細(xì)胞的浸潤(圖5L)。這些動物模型表明,選擇性YAP1缺失具有腫瘤抑制作用,并激活CD8+ T細(xì)胞的抗腫瘤功能。
6. 靶向ECM-CAF的選擇性YAP1缺失可提高體內(nèi)抗PD-1抗體的免疫治療效果
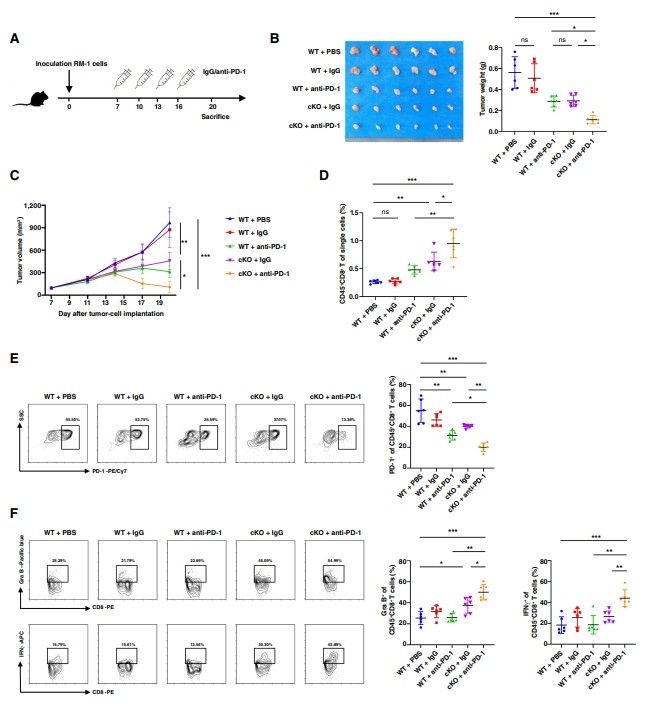
圖6 靶向ECM-CAF的選擇性YAP1缺失可提高體內(nèi)抗PD-1抗體的免疫治療效果
基于其抗腫瘤作用,作者假設(shè)靶向ECM-CAF的選擇性YAP1缺失可以提高ICB在前列腺癌中的療效,并在一定程度上逆轉(zhuǎn)冷TME的困境。因此,作者進(jìn)行了抗PD-1聯(lián)合治療試驗。作者用cKO小鼠模擬選擇性YAP1耗竭。作者在移植RM-1腫瘤7天后給予抗PD-1抗體(圖6A)。因此,cKO聯(lián)合抗PD-1抗體治療比單獨使用cKO或抗PD-1抗體治療效果更好(圖6B和C)。此外,聯(lián)合治療促進(jìn)CD8+ t細(xì)胞浸潤,降低耗盡標(biāo)志物PD-1的表達(dá),促進(jìn)激活標(biāo)志物Gra B和IFNγ(圖6D-F),從而顯示出強(qiáng)大的腫瘤抑制功能和增強(qiáng)免疫激活反應(yīng)。這些結(jié)果表明,靶向ECM-CAF的選擇性YAP1耗盡是一種很有前景的策略,可以顯著提高抗PD-1抗體的治療效果,并可能在臨床應(yīng)用中有效。
總之,作者的工作揭示并鑒定了兩種CAF亞型的特征標(biāo)記:ECM-CAF是由TGFβ刺激和高分泌的ECM誘導(dǎo)的,表現(xiàn)出致瘤表型,而Lym-CAF是由淋巴細(xì)胞分泌的TNFα/IFNγ誘導(dǎo)的,表現(xiàn)出高分泌細(xì)胞因子的抗腫瘤表型。YAP1和NF-κB p65是它們各自的核心轉(zhuǎn)錄因子,YAP1和p65的相互作用導(dǎo)致ECM-CAF和Lym-CAF之間的表型轉(zhuǎn)換。靶向ECM-CAF的選擇性YAP1缺失可將原蛋白cas轉(zhuǎn)換為抗腫瘤cas,增強(qiáng)抗PD-1抗體對前列腺癌的治療效果。
結(jié)論:
作者的團(tuán)隊之前發(fā)現(xiàn)CD248主要在基質(zhì)中表達(dá),尤其是在大多數(shù)實體腫瘤的caf中,被認(rèn)為是癌癥治療的理想靶點。在這項研究中,經(jīng)過抗PD-1抗體治療的選擇性YAP1缺失小鼠在前列腺癌中顯示出令人鼓舞的腫瘤限制作用。作者的團(tuán)隊將繼續(xù)致力于針對cas的YAP1耗竭治療策略,如抗體-藥物偶聯(lián)物和靶向cd248的納米藥物遞送。
實驗方法:
差異基因表達(dá)分析、基因本體分析、基因集富集分析、轉(zhuǎn)錄因子富集分析、單細(xì)胞RNA測序、RNA測序、免疫熒光染色、共免疫沉淀、雙熒光素酶報告基因檢測、Western Blot、細(xì)胞培養(yǎng)與CAF誘導(dǎo)、構(gòu)建前列腺癌類器官模型、細(xì)胞共培養(yǎng)實驗、流式細(xì)胞術(shù)、細(xì)胞功能實驗、腫瘤異種移植模型、基因敲除小鼠模型、人源化免疫重建模型、HE染色、免疫組化和免疫熒光染色評估腫瘤組織中CAF亞型的分布和特征標(biāo)記物的表達(dá)、H&E染色和AFM檢測腫瘤組織中的膠原沉積情況
參考文獻(xiàn):
Song, Hongtao et al. “YAP1 Inhibition Induces Phenotype Switching of Cancer-Associated Fibroblasts to Tumor Suppressive in Prostate Cancer.” Cancer research vol. 84,22 (2024): 3728-3742. doi:10.1158/0008-5472.CAN-24-0932






