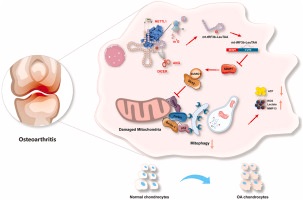
m7G修飾的mt-tRF3b-LeuTAA通過軟骨細胞中SIRT3的SUMO化來調節線粒體自噬和代謝重編程
骨關節炎(OA)是一種退行性疾病,軟骨細胞退化是其發展的關鍵。越來越多的證據表明,m7G RNA修飾與OA病理過程相關,但其在軟骨細胞退化中的具體作用尚不明確。在該研究中,作者發現,在骨關節炎軟骨細胞中,METTL1 和 m7G的水平顯著升高。此外,METTL1介導的m7G修飾會上調線粒體轉運 RNA 衍生片mt-tRF3b-LeuTAA的表達,從而加劇軟骨細胞的退變。從機制上講,mt-tRF3b-LeuTAA 會降低 SUMO 特異性蛋白酶 1(SENP1)的蛋白表達,并上調去乙酰化酶 3(SIRT3)的 SUMO 化水平,進而抑制 PTEN 誘導激酶 1(PINK1)/ 帕金蛋白(Parkin)介導的線粒體自噬。關節腔內注射聚酰胺-胺-聚乙二醇表面修飾的含最小自肽和軟骨細胞親和肽的mt-tRF3b-LeuTAA抑制劑(PMC)可在體內減輕內側半月板失穩(DMM)小鼠軟骨的退變。作者的研究表明,METTL1/m7G/mt-tRF3b-LeuTAA 軸通過SIRT3的SUMO化抑制線粒體自噬并促進線粒體功能障礙,從而加速軟骨降解,并且提示靶向METTL1及其下游信號軸可能是骨關節炎治療的一個有前景的治療靶點。該研究于2024年10月發表在《Biomaterials》上,IF:12.8。
技術路線:
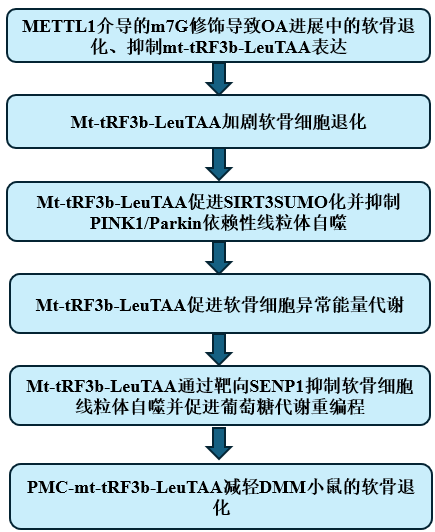
主要研究結果:
1.METTL1介導的m7G修飾導致OA進展中的軟骨退化
為了研究m7G甲基轉移酶修飾在軟骨退化中的作用,作者通過RNA-seq技術檢查了m7G調節劑的表達。作者發現METTL1表達在OA軟骨細胞中顯著升高(圖1A和B)。此外,基質金屬蛋白酶13(MMP13)表達和m7G修飾水平在OA軟骨細胞中顯著增加,而膠原蛋白II型alpha1(COL2A1)表達顯著降低(圖1C和D,n=30)。Kellgren-Lawrence等級用于評估軟骨樣本的退化等級(KLG;0-4)。結果顯示METTL1表達與OA進展中的m7G修飾水平呈顯著相關性(圖1E)。
為了進一步驗證METTL1介導的m7G修飾是否會加速OA的病理進展,將METTL1過表達質粒或METTL1-sh質粒轉染到原代人軟骨細胞中。作者觀察到METTL1過表達顯著上調了MMP13表達并下調了COL2A1表達。同時,m7G的總水平顯著增加(圖1F-H)。此外,功能獲得和喪失實驗表明,過表達和沉默METTL1均顯著影響軟骨細胞增殖、凋亡以及合成代謝和分解代謝標志物的表達(圖1I和J)。總之,這些發現表明METTL1介導的m7G修飾有助于OA中的軟骨細胞退化。
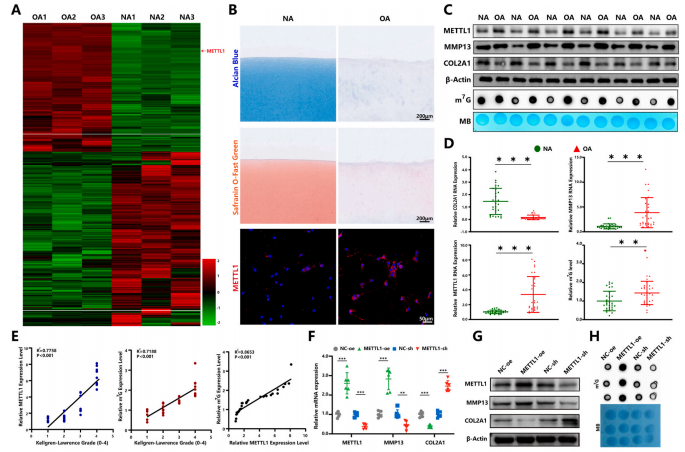
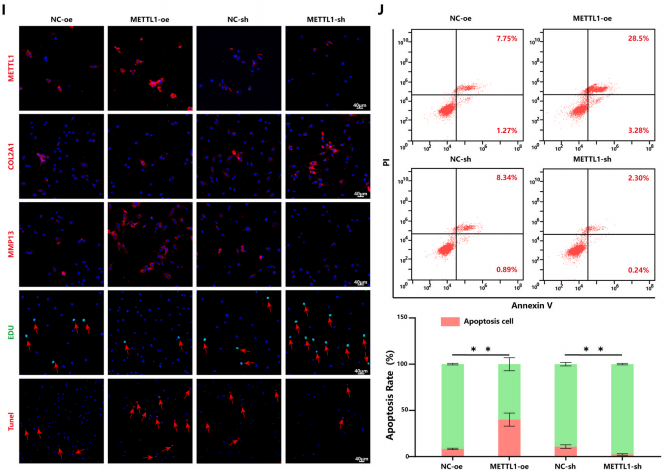
圖 1. OA軟骨細胞中的METTL1表達和m7G修飾水平促進軟骨細胞退化
2.METTL1介導的m7G修飾抑制mt-tRF3b-LeuTAA表達
m7G是一種常見的tRNA衍生片段修飾,在原核生物、真核生物和一些古細菌中高度保守。為了進一步探索METTL1介導的m7G修飾的具體機制,進行了arraystar人類m7G小RNA表觀轉錄組微陣列。作者注意到軟骨細胞中許多tRF具有m7G修飾(圖2A-C)。在臨床樣本中篩選并驗證了六種具有高m7G修飾的tRF。其中,與正常軟骨細胞相比,mt-tRF3b-LeuTAA表達在OA軟骨細胞中更穩定且更高(圖2D)。mt-tRF3bLeuTAA源自mt-tRNALeuTAA,其源tRNA序列和結構是從MINT基礎數據庫中獲得的(圖2D)。
Pearson相關性分析顯示mt-tRF3b-LeuTAA表達與m7G修飾、METTL1水平和KLG之間存在很強的相關性(圖2E)。此外,m7G修飾RNA免疫沉淀表明mt-tRF3b-LeuTAA在m7G位點高度富集(圖2F)。METTL1敲低上調了mttRF3b-LeuTAA的表達,這與METTL1過表達形成對比(圖2G)。免疫熒光(IF)和熒光原位雜交(FISH)顯示METTL1和mt-tRF3b-LeuTAA在軟骨細胞中共定位(圖2H和I)。以上結果表明mt-tRF3bLeuTAA上存在m7G修飾,而METTL1是該修飾的原因。
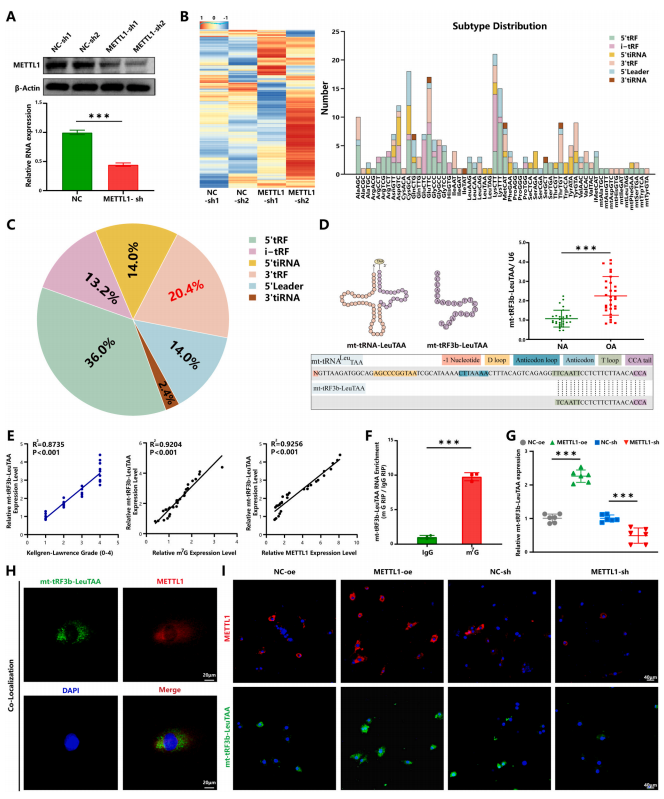
圖2. METTL1介導的m7 G-甲基化tRNA衍生片段的鑒定
3.Mt-tRF3b-LeuTAA加劇軟骨細胞退化
為了進一步研究mt-tRF3b-LeuTAA在OA中的作用,將mt-tRF3bLeuTAA模擬物、mt-tRF3b-LeuTAA抑制劑和對照轉染到軟骨細胞中。IF結果顯示,mt-tRF3bLeuTAA模擬物增加了軟骨細胞中MMP13的表達并降低了COL2A1的表達。然而,mt-tRF3b-LeuTAA抑制劑產生了相反的效果。此外,mt-tRF3b-LeuTAA模擬物D.LongetalBiomaterials314(2025)122903通過EdU測定抑制了軟骨細胞增殖,并通過流式細胞術和TUNEL測定增加了軟骨細胞凋亡。Westernblot分析顯示,mttRF3b-LeuTAA模擬物上調了軟骨細胞外基質中分解代謝標志物(MMP13、RUNX2和ADAMTS4)的水平,并降低了軟骨相關合成代謝標志物(Aggrecan、SOX9和COL2A1)的水平。這些結果表明mt-tRF3b-LeuTAA導致OA中的軟骨退化。
tRF可以通過靶向mRNA來抑制基因轉錄。作者利用生物信息學數據庫(miRanda、TargetScan和tRFTars)預測并篩選了mt-tRF3b-LeuTAA靶向的6個mRNA,包括TNF受體相關因子2(TARF2)、甲狀腺激素受體相互作用蛋白4(TRIP4)、C-X-C基序趨化因子配體8(CXCL8)、細胞周期蛋白D2(CCND2)、ras相關蛋白Rab-2A(RAB2A)和sentrin特異性蛋白酶1(SENP1)。在軟骨細胞中過表達mt-tRF3bLeuTAA后,只有SENP1表達顯著降低,這表明SENP1是mt-tRF3b-LeuTAA的有效下游靶點。這些發現表明mt-tRF3b-LeuTAA可能通過靶向SENP1促進軟骨細胞退化。

圖 3. mt-tRF3b-LeuTAA 通過 PINK1/Parkin 通路促進 SIRT3 SUMO 化,從而抑制軟骨細胞線粒體自噬
4.Mt-tRF3b-LeuTAA促進SIRT3SUMO化并抑制PINK1/Parkin依賴性線粒體自噬
作者之前的研究表明,SIRT3通過PINK1/Parkin通路激活線粒體自噬。其他研究表明,SIRT3含有1型SUMO化(SUMO1)位點,SUMO1修飾可通過降低底物去乙酰化活性來抑制SIRT3功能。為了驗證mt-tRF3b-LeuTAA是否通過PINK1/Parkin通路影響SIRT3SUMO化和線粒體自噬,在原代人軟骨細胞中敲低或過表達mt-tRF3b-LeuTAA。作者發現mt-tRF3b-LeuTAA模擬物導致總SUMO1修飾更高,而mt-tRF3b-LeuTAA抑制劑具有相反的效果(圖3A和B)。免疫共沉淀實驗證實mt-tRF3b-LeuTAA模擬物增強了SIRT3SUMO1修飾(圖3C-F)。為進一步探討mt-tRF3b-LeuTAA調控軟骨細胞線粒體自噬的機制,作者進行了Westernblot、mRFP-GFP-LC3雙標腺病毒及mito-Keima實驗。結果顯示mt-tRF3b-LeuTAA模擬物抑制了軟骨細胞線粒體自噬相關蛋白Parkin、LC3II/I、Beclin-1及COL2A1,增加了P62及MMP13。此外,mt-tRF3b-LeuTAA模擬物增加了凋亡相關蛋白BAX,抑制了增殖相關蛋白Bcl-2(圖3G)。mRFP-GFP-LC3、透射電子顯微鏡(TEM)和線粒體-凱馬分析顯示,mt-tRF3b-LeuTAA模擬物下調了軟骨細胞中的線粒體自噬通量(圖3H-J)。這些發現表明,mt-tRF3b-LeuTAA促進SIRT3SUMO化并抑制OA中的PINK1/Parkin依賴性線粒體自噬。

圖 4. mt-tRF3b-LeuTAA 通過線粒體自噬調節軟骨細胞葡萄糖代謝重編程
5.Mt-tRF3b-LeuTAA促進軟骨細胞異常能量代謝
線粒體自噬也與能量代謝有關,包括氧化磷酸化 (OXPHO) 和糖酵解。為了確定mt-tRF3b-LeuTAA是否調節軟骨細胞中的OXPHO和糖酵解,對線粒體的代謝功能進行了評估。作者發現mttRF3b-LeuTAA模擬了活性氧(ROS)生成增加(圖4A和B),以及線粒體膜電位降低、軟骨細胞增殖和細胞凋亡增加(圖4C和D)。Westernblot分析顯示,mttRF3b-LeuTAA模擬物可導致糖代謝相關酶水平升高,包括葡萄糖轉運蛋白1型(GLUT1)、己糖激酶2(HK2)、磷酸果糖激酶(PFKP)、丙酮酸激酶肌同工酶M2(PKM2)和丙酮酸脫氫酶E1(PDHA)(圖4E)。此外,mt-tRF3b-LeuTAA模擬物可降低耗氧率(OCR)水平,增加乳酸生成,減少ATP生成(圖4F)。然而,在軟骨細胞中敲低mt-tRF3b-LeuTAA則會引起相反的效果。這些結果證實,mt-tRF3b-LeuTAA下調線粒體自噬并促進糖酵解,破壞正常的能量代謝,導致OA中持續的ROS和乳酸沉積。
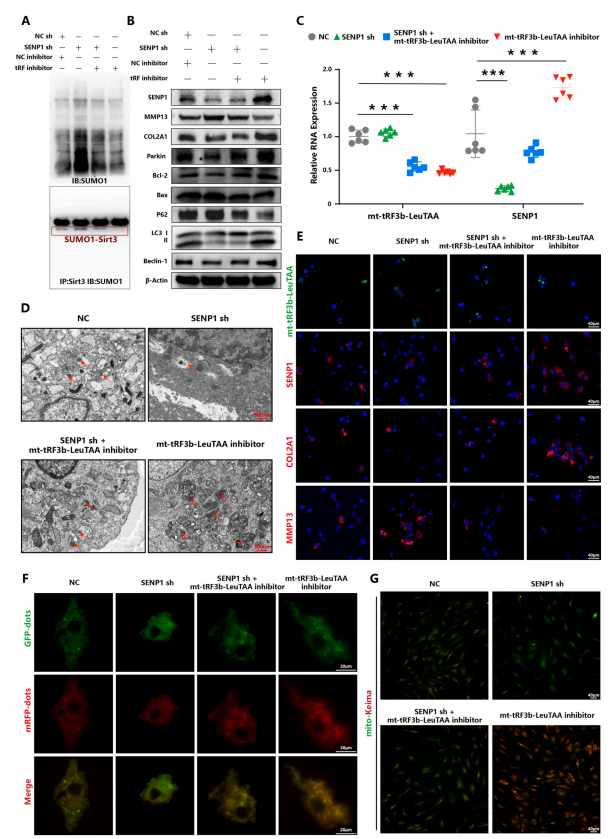
圖 5. mt-tRF3b-LeuTAA 通過靶向 SENP1 抑制軟骨細胞線粒體自噬
6.Mt-tRF3b-LeuTAA通過靶向SENP1抑制軟骨細胞線粒體自噬并促進葡萄糖代謝重編程
SENP1作為SUMO1修飾的主要調控酶,對SIRT3SUMO1修飾具有較高的水解效率。為了確認mt-tRF3b-LeuTAA是否通過靶向SENP1增強SIRT3SUMO1修飾并抑制PINK1/Parkin介導的線粒體自噬,作者進行了一系列實驗。首先,將mt-tRF3b-LeuTAA模擬物和mt-tRF3b-LeuTAA抑制劑轉染到原代人軟骨細胞中。作者發現mt-tRF3b-LeuTAA模擬物顯著抑制了SENP1的表達,這與mt-tRF3b-LeuTAA抑制劑形成對比。
然后,將mt-tRF3b-LeuTAA和SENP1分別或同時轉染到軟骨細胞中。結果表明,SENP1敲低增強了總SUMO1修飾和SIRT3SUMO1修飾(圖5A)。此外,SENP1敲低通過檢測mRFP-GFP-LC3、mito-Keima和線粒體自噬相關蛋白表達水平抑制了PINK1/Parkin介導的線粒體自噬(圖5B-G)。同時,作者還發現SENP1敲低降低了線粒體膜電位,增加了ROS生成(圖6A-D),并促進了糖酵解(圖6E和F)。重要的是,通過轉染mt-tRF3b-LeuTAA抑制劑可以挽救SENP1敲低的影響。此外,SENP1過表達檢測到了相反的效果,而通過用mt-tRF3b-LeuTAA模擬物轉染可以挽救這些效果,進一步支持SENP1作為mt-tRF3b-LeuTAA的功能介質。最后,作者通過Targetscan和miRbase數據庫預測了mt-tRF3b-LeuTAA和SENP1的潛在結合位點。作者發現mt-tRF3bLeuTAA與SENP1mRNA的3′-非翻譯區(UTR)結合。此外,雙熒光素酶報告基因測定證實mttRF3b-LeuTAA可以直接結合SENP1mRNA3′-UTR。
總體而言,這些結果表明mt-tRF3b-LeuTAA靶向SENP1來調節SIRT3SUMO1修飾,從而抑制PINK1/Parkin介導的線粒體自噬并促進軟骨細胞中的葡萄糖代謝重編程。
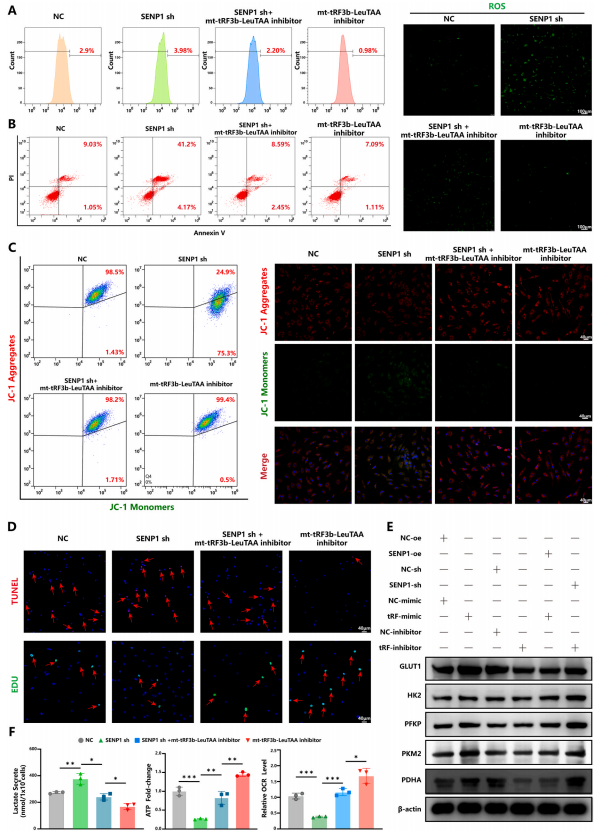
圖6. mt-tRF3b-LeuTAA 通過靶向SENP1 促進軟骨細胞代謝重編程
7構建針對軟骨細胞的高親和力納米載體
基于上述mt-tRF3b-LeuTAA調控軟骨細胞穩態的機制,作者進一步探索mt-tRF3b-LeuTAA在OA中的治療潛力。首先,構建軟骨細胞親和性及吞噬細胞逃逸性納米粒子,以聚酰胺胺(PAMAM)為載體,將最小“自身”肽(MSP)和軟骨細胞親和肽(CAP)附著于納米載體上(圖7A),將該納米載體體系命名為PMC(Polyamidoamine-polyethyleneglycolsurface-modifiedwithMinimalself-peptidesandChondrocyte-affinitypeptides)。游離miRNA形成的亮帶在PMC處完全消失,tRF的重量比為0.5–14,表明tRF分子已被PMC復合和阻滯。瓊脂糖凝膠電泳表明,在N/P比為8時,所有tRF分子均未復合(圖7B)。細胞毒性試驗表明,在40-50%聚乙二醇(PEG)的納米膠囊對原代人軟骨細胞的毒性較低,而RT-qPCR測定發現PEG比例為40%的納米膠囊可提供更佳的遞送效果(圖7C和D)。
然后,將mt-tRF3b-LeuTAA裝載到PMC中。平均粒徑為45.8nm,正電荷為10.7mV(圖7E-G)。為了評估PMC的降解和持續釋放,將OA滑液與PMC-mt-tRF3b-LeuTAA和裸露的mt-tRF3b-LeuTAA一起孵育。RNA擴增和瓊脂糖凝膠電泳顯示與PMC培養24h后可檢測到條帶(圖7H)。
接下來,將人軟骨外植體與PMC-mt-tRF3bLeuTAA(FITC)或Nakedmt-tRF3b-LeuTAA(FITC)一起培養24h,進行體外滲透實驗。結果顯示PMC-mt-tRF3b-LeuTAA組熒光增強,而Nakedmt-tRF3b-LeuTAA組呈現相反趨勢(圖7I)。同樣,將巨噬細胞和軟骨細胞與PMC-mttRF3b-LeuTAA或Nakedmt-tRF3b-LeuTAA一起培養24h。在PMC-mt-tRF3bLeuTAA組中,軟骨細胞比巨噬細胞表現出更強的熒光。(圖7J)。然后,作者通過將PMC-mt-tRF3b-LeuTAA添加到六種不同類型的細胞中來研究PMC的靶向軟骨細胞能力。結果表明,與其他類型的細胞相比,軟骨細胞特異性地吸收了PMC-mt-tRF3b-LeuTAA。最重要的是,PMC-mt-tRF3b-LeuTAA是一種很有前途的納米載體,可用于進一步評估OA的體內治療效果。
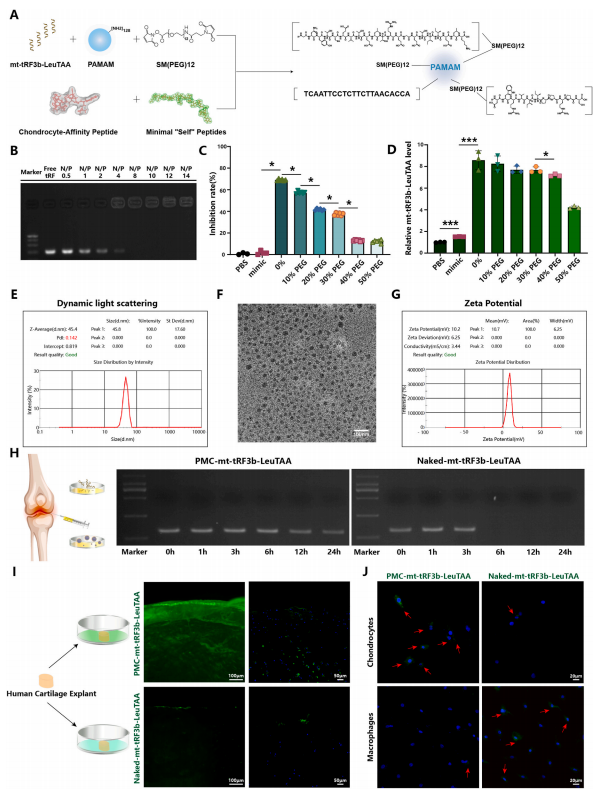
圖 7. 軟骨細胞親和吞噬細胞逃逸納米粒子促進 mt-tRF3b-LeuTAA 遞送到軟骨細胞中
8.PMC-mt-tRF3b-LeuTAA減輕DMM小鼠的軟骨退化
為了驗證PMC-mt-tRF3b-LeuTAA在體內治療OA的效果,合成了Cy5.5標記的mt-tRF3b-LeuTAA,并制備了相應的納米遞送材料和裸RNA對照。對雄性C57BL/6小鼠進行關節內注射。三周后,器官采集和成像顯示PMC-mt-tRF3b-LeuTAA和裸RNA對照組之間沒有顯著差異,表明PMC-mt-tRF3b-LeuTAA在體內的毒性很小。體內成像顯示裸mt-tRF3b-LeuTAA的熒光隨時間下降的速度比PMC-mt-tRF3b-LeuTAA更快。
然后對雄性C57BL/6小鼠進行內側半月板失穩術(DMM),建立OA模型。所有小鼠隨機分為Sham組、DMM組、DMM+Nakedmt-tRF3b-LeuTAA組、DMM+PMC-mttRF3b-LeuTAA組和DMM+PMC-mt-tRF3b-LeuTAA抑制劑組。DMM+Control組小鼠注射Nakedmt-tRF3bLeuTAA,DMM+PMC組小鼠注射PMCmt-tRF3b-LeuTAA或DMM+PMC-mt-tRF3b-LeuTAA抑制劑。術后10周,軟骨關節間隙、層表面、基質染色、軟骨細胞排列、細胞萎縮、反應性聚集、軟骨下骨血管增生等均有明顯差異(圖8A)。免疫組織化學和免疫熒光顯示DMM+PMC-mt-tRF3b-LeuTAA組的MMP13、COL10A1、RUNX2表達較高,COL2A1和Aggrecan表達較低,而DMM+PMC-mt-tRF3b-LeuTAA抑制劑組則呈現相反趨勢(圖8B)。小鼠膝關節的微型計算機斷層掃描評估了骨贅和硬化半月板。與單純DMM組相比,DMM+PMC-mt-tRF3b-LeuTAA組的骨贅體積和等級較高,而DMM+PMCmt-tRF3b-LeuTAA抑制劑組檢測到的骨贅較低(圖8C)。這些發現意味著PMC-mt-tRF3b-LeuTAA抑制劑可減輕DMM小鼠的軟骨退化。綜上所述,PMC可以有效地將tRF遞送到軟骨細胞中,為OA提供一種有前景的基于納米技術的精準靶向策略。

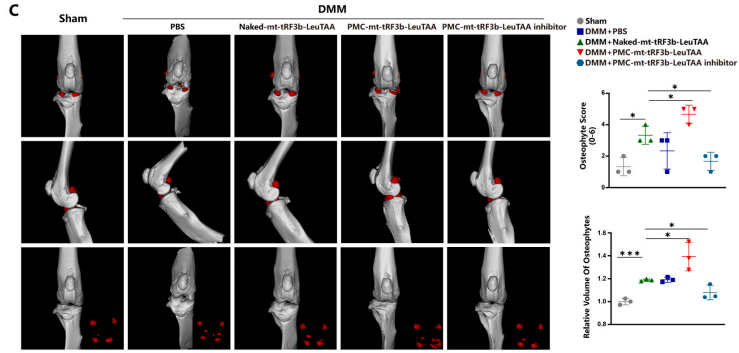
圖 8. PMC-mt-tRF3b-LeuTAA 抑制劑減輕 DMM 小鼠的軟骨退化
結論:
綜上所述,METTL1 介導的m7 G修飾上調了mt-tRF3b-LeuTAA的表達,而mt-tRF3bLeuTAA則通過靶向SENP1來促進SIRT3 SUMO1修飾,從而抑制 SIRT3的功能。該過程抑制了軟骨細胞線粒體自噬,促進了糖酵解和代謝重編程,并加速了軟骨細胞的退化。在轉化應用中,mt-tRF3bLeuTAA代表了研究線粒體自噬和OA進展的新靶點。此外,作者合成了一種新型納米載體PMC,可顯著增強tRF進入軟骨細胞,并為OA中的tRF特異性核酸藥物提供了一種新的治療策略。
參考文獻:
Long D, Deng Z, Zhao X, et al. m7G-modified mt-tRF3b-LeuTAA regulates mitophagy and metabolic reprogramming via SUMOylation of SIRT3 in chondrocytes. Biomaterials. Published online October 23, 2024. doi:10.1016/j.biomaterials.2024.122903
實驗方法:
組織病理學染色、qPCR、WB、Dot blot、RT-qPCR、免疫熒光染色、流式細胞術、熒光原位雜交、TUNEL、 CCK-8、micro-CT、骨關節炎小鼠模型的構建






