高級(jí)別漿液性卵巢癌 PTEN 丟失與巨噬細(xì)胞動(dòng)力學(xué)的關(guān)系
高級(jí)別漿液性卵巢癌(HGSC)仍然是一種預(yù)后不良的疾病,對(duì)目前的免疫檢查點(diǎn)抑制劑無反應(yīng)。雖然 PI3K 途徑的改變,如 PTEN 缺失,在 HGSC 很常見,但是針對(duì)這一途徑的嘗試并不成功。我們假設(shè)異常的 PI3K 途徑激活可能改變 HGSC 免疫微環(huán)境并提供靶向機(jī)會(huì)。單細(xì)胞 RNA 測(cè)序鑒定了小鼠模型中特異于 Pten 無效網(wǎng)膜腫瘤的駐留巨噬細(xì)胞群體,流式細(xì)胞術(shù)證實(shí)了這一點(diǎn)。這些巨噬細(xì)胞來源于腹腔液巨噬細(xì)胞,表現(xiàn)出獨(dú)特的基因表達(dá)程序,以血紅素加氧酶 -1(HMOX1)的高表達(dá)為標(biāo)志。靶向腹腔巨噬細(xì)胞阻止了 HMOX1hi 巨噬細(xì)胞的出現(xiàn),減少了腫瘤的生長(zhǎng)。此外,直接抑制 HMOX1延長(zhǎng)體內(nèi)存活。RNA 測(cè)序鑒定了 Pten 缺失腫瘤細(xì)胞中的 IL33作為可能的候選驅(qū)動(dòng)因子,導(dǎo)致了 HMOX1hi 巨噬細(xì)胞的出現(xiàn)。人類 HGSC 腫瘤中也含有 HMOX1hi 巨噬細(xì)胞及其相應(yīng)的基因表達(dá)程序。此外,這些巨噬細(xì)胞的存在與激活的腫瘤 PI3K/mTOR 信號(hào)傳導(dǎo)和 HGSC 患者的總生存率差有關(guān)。相比之下,HMOX1hi 巨噬細(xì)胞數(shù)量少的腫瘤表現(xiàn)為適應(yīng)性免疫應(yīng)答基因表達(dá)增加。這些數(shù)據(jù)表明靶向 HMOX1hi 巨噬細(xì)胞是治療不良預(yù)后 HGSC 的一種潛在的治療策略。本文于2024年11月發(fā)表于《Cancer Immunology》,IF:12.5
研究技術(shù)路線:
研究結(jié)果:
1. Pten-null細(xì)胞依賴于腫瘤微環(huán)境加速腫瘤生長(zhǎng)
為了解決 PTEN 缺失如何影響 HGSC 生長(zhǎng),我們利用匹配的 ID8細(xì)胞,單獨(dú)使用 Trp53或我們以前產(chǎn)生的 Trp53和 PTEN 中的失活突變。使用多個(gè)單獨(dú)的克隆,我們證實(shí)在腹膜內(nèi)注射后,與 Trp53-/-相比,Trp53-/-; Pten-/-ID8細(xì)胞導(dǎo)致顯著縮短的存活(圖1A)。如前所述,Pten 缺失在2D 高附著條件下(圖1B 和 C) ,包括具有額外的 Brca2突變(圖1D)以及在低血清和血清饑餓條件下(圖1E) ,提示增強(qiáng)的腹膜內(nèi)生長(zhǎng)不是腫瘤細(xì)胞固有的。
腫瘤細(xì)胞必須抵抗失巢凋亡,然后在低附著條件下生長(zhǎng),以促進(jìn) HGSC 的腹膜播散。Trp53-/-和 Trp53-/-; Pten-/-ID8克隆在體外低附著條件下形成球狀簇,但隨著時(shí)間的推移,兩種基因型的收縮率是相等的(圖1F)。在體內(nèi),Pten 丟失在腹腔注射后沒有立即的生存優(yōu)勢(shì)(圖1G)。S1C)。然而,注射后14天,腹腔液中 Pten 無效細(xì)胞顯著擴(kuò)增(圖1G)。此外,在注射 Trp53-/-; Pten-/-細(xì)胞的小鼠中,HGSC 轉(zhuǎn)移的主要部位網(wǎng)膜中的腫瘤負(fù)荷在第14天更大,在第25至28天顯著更大(圖1H)。
為了確保我們的發(fā)現(xiàn)不是 ID8特異性的,我們使用了 HGS2,一種由 Trp53fl/fl,Brca2fl/fl,Ptenfl/fl,Pax8Cre 轉(zhuǎn)基因小鼠中產(chǎn)生的腫瘤產(chǎn)生的細(xì)胞系。我們使用慢病毒在 HGS2中重新表達(dá) Pten,這并不影響倍增時(shí)間在二維高附著(圖1I)或形成球體的能力在低附著(圖1J)。但與對(duì)照病毒感染的細(xì)胞相比,在體內(nèi)產(chǎn)生較小的網(wǎng)膜腫瘤(圖1K)。總之,這些數(shù)據(jù)強(qiáng)烈表明腹膜微環(huán)境支持 Pten 無效腫瘤的加速生長(zhǎng)。
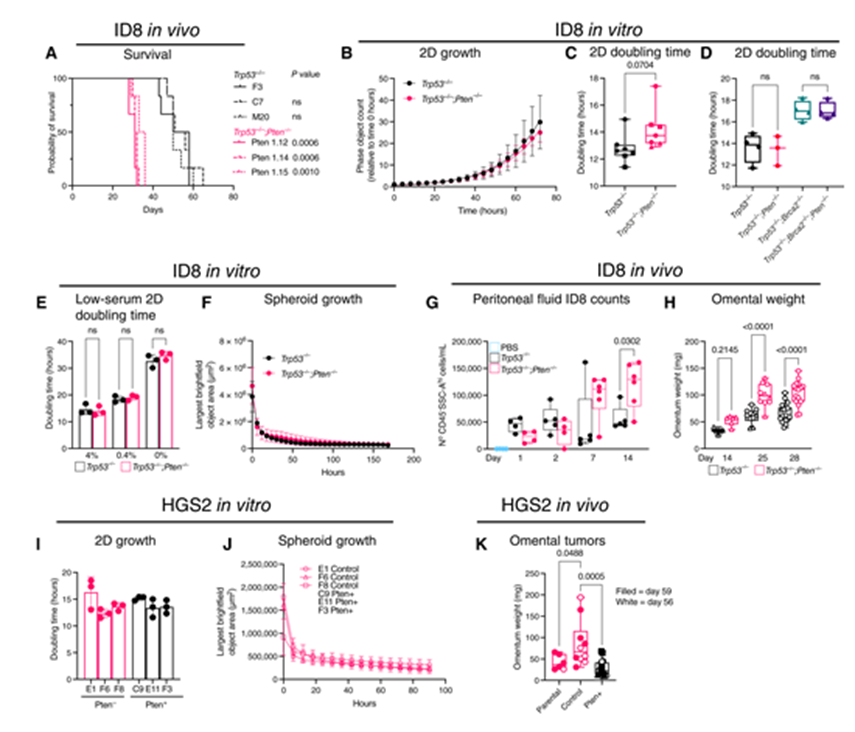
Figure 1 Pten-null細(xì)胞依賴于腫瘤微環(huán)境加速腫瘤生長(zhǎng)
2. Pten-null腫瘤細(xì)胞增強(qiáng)了網(wǎng)膜內(nèi)駐留樣巨噬細(xì)胞的積累
我們假設(shè)巨噬細(xì)胞支持 Pten-null腫瘤的播種和生長(zhǎng)。在小鼠的腹膜腔和網(wǎng)膜中存在兩個(gè)主要的巨噬細(xì)胞群體: 不斷由血液 Ly6Chi 單核細(xì)胞補(bǔ)充的 F4/80loMHCIIhi 單核細(xì)胞來源的巨噬細(xì)胞和胚胎來源的 F4/80hiMHCIIlo 駐留巨噬細(xì)胞,它們都是自我維持和從當(dāng)?shù)氐?/span> F4/80loMHCIIhi 庫中補(bǔ)充的。在確認(rèn)了我們的門控策略的特殊性之后,我們首先評(píng)估了巨噬細(xì)胞/單核細(xì)胞群在腫瘤生長(zhǎng)過程中的變化。ID8細(xì)胞注射1天內(nèi)引起 Ly6Chi 單核細(xì)胞流入腹腔液。在 Trp53-/-; Pten-/-注射的小鼠中,這種浸潤在第14天顯著增加(圖2A)。可能來源于該單核細(xì)胞庫的 F4/80loMHCIIhi 巨噬細(xì)胞的增加(圖2B)在 Trp53-/-; Pten-/-注射后14天也是明顯的。在 Trp53-/-; Pten-/-注射的小鼠中,網(wǎng)膜駐留的 F4/80hiMHCIIlo 群體在第14天增加(圖2C)。有趣的是,在第28天,當(dāng)兩種基因型都有相當(dāng)大的腫瘤負(fù)荷時(shí),Trp53-/-; Pten-/-網(wǎng)膜腫瘤在多個(gè)亞克隆中含有顯著更多的駐留樣巨噬細(xì)胞(圖2D)。此外,大約40% 的駐留樣巨噬細(xì)胞表達(dá)長(zhǎng)期駐留標(biāo)記 TIM4 + ,表明它們不是新招募的(圖2E 和 F)。
我們還使用了具有或不具有 Pten-null的 Trp53-/-; Brca2-/-ID8細(xì)胞。單獨(dú)的 Brca2缺失并不影響駐留巨噬細(xì)胞的擴(kuò)張(圖2G)。然而,Pten 的額外缺失再次顯著增加了駐留巨噬細(xì)胞的密度(圖2G) ,這與單核細(xì)胞來源的巨噬細(xì)胞和 T 細(xì)胞的相對(duì)缺乏相結(jié)合(圖2H 和 I)。這與體內(nèi)侵略性的增加有關(guān)。除了 Pten 之外,Brca2的缺失拯救了單獨(dú)使用 Pten 損失觀察到的單核細(xì)胞衍生的巨噬細(xì)胞和 T 細(xì)胞的募集(圖2J 和 K) ,表明 Pten 缺失特異性地改變駐留巨噬細(xì)胞而不是誘導(dǎo)免疫微環(huán)境中的全局變化。
為了確定駐留巨噬細(xì)胞是否是Pten-null網(wǎng)膜腫瘤生長(zhǎng)的驅(qū)動(dòng)因素,我們首先在腫瘤接種之前使用腹膜內(nèi)氯膦酸鹽包封的脂質(zhì)體(CEL)耗盡所有巨噬細(xì)胞。這種泛巨噬細(xì)胞的消耗完全阻止了 Trp53-/-; Pten-/-網(wǎng)膜腫瘤的形成和腹水的產(chǎn)生(圖2L)。不幸的是,如先前報(bào)道的,CEL 注射后觀察到的高死亡率阻礙了我們機(jī)構(gòu)使用 CEL 的進(jìn)一步研究。為了進(jìn)一步解剖巨噬細(xì)胞對(duì) Pten-null腫瘤生長(zhǎng)的貢獻(xiàn),我們利用缺乏 Ccr2的一個(gè)(Ccr2RFP/+)或兩個(gè)拷貝(Ccr2RFP/RFP)的小鼠,因此顯著減少了骨髓單核細(xì)胞的出口。正如預(yù)期的那樣,Ccr2RFP/+ 和 Ccr2RFP/RFP 小鼠的腹膜液和網(wǎng)膜中的單核細(xì)胞和單核細(xì)胞來源的巨噬細(xì)胞顯著減少,駐留巨噬細(xì)胞庫沒有改變。引人注目的是,Ccr2的缺失顯著增加了 Trp53-/-; Pten-/-注射的小鼠中的腫瘤負(fù)荷和腹水體積(圖2M) ,表明單核細(xì)胞衍生的巨噬細(xì)胞在 Pten-null腫瘤接種和生長(zhǎng)期間具有保護(hù)性抗腫瘤作用。
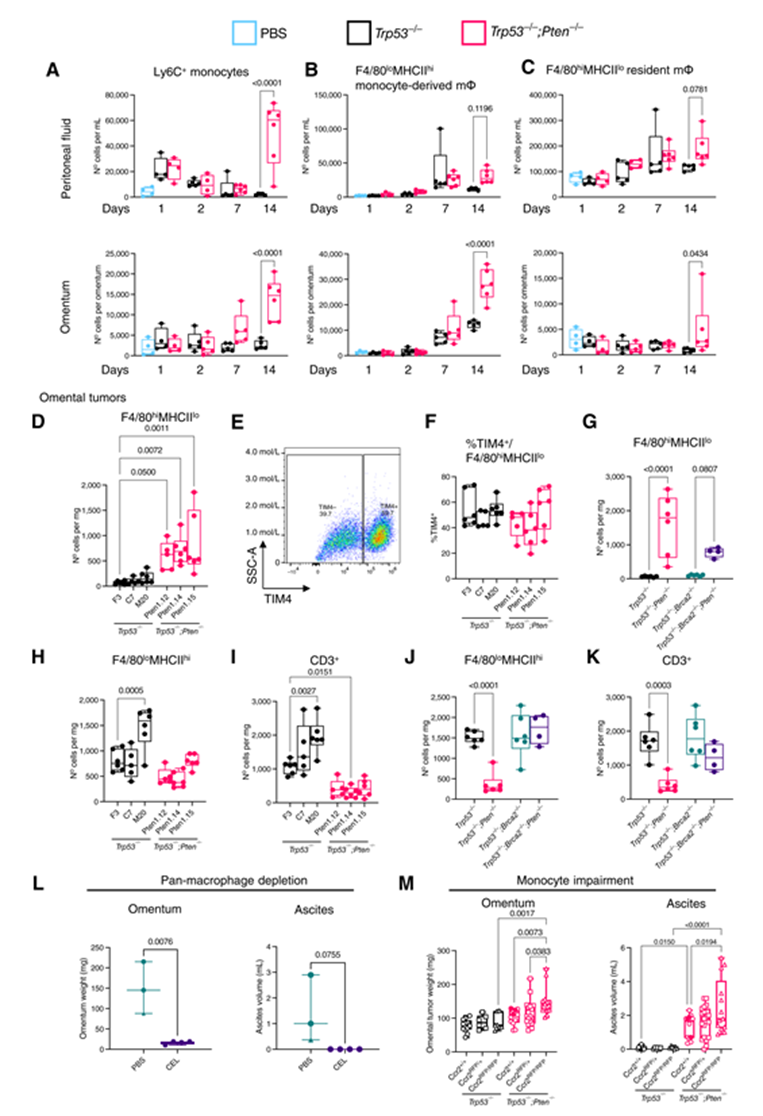
Figure 2 Pten-null的腫瘤細(xì)胞增強(qiáng)了網(wǎng)膜內(nèi)駐留樣巨噬細(xì)胞的積累
3. Pten-null腫瘤驅(qū)動(dòng)一個(gè)獨(dú)特的 HMOX1hi 巨噬細(xì)胞亞群的出現(xiàn)
巨噬細(xì)胞表型不能簡(jiǎn)化為二元 M1/M2標(biāo)記物表達(dá),網(wǎng)膜腫瘤中存在多種不同的亞型。因此,我們使用 SMART-Seq2方案對(duì)來自網(wǎng)膜腫瘤的流式分選巨噬細(xì)胞進(jìn)行 scRNA-seq。統(tǒng)一流形近似和投影聚類顯示了五個(gè)不同的聚類(圖3A 和 B)。簇0表達(dá)在單核細(xì)胞衍生的巨噬細(xì)胞中經(jīng)典發(fā)現(xiàn)的基因,包括 MHCII 相關(guān)分子(H2-Eb1,H2-DMb2,H2-DMb1,H2-Ab1,Cd74,H2-Oa 和 H2-Aa) ,趨化因子受體 Ccr2,Cx3cr1和共刺激分子 Cd86。通過流式細(xì)胞術(shù),簇0也定位于 F4/80loMHCIIhi 區(qū)(圖3C)。簇1和簇3均表達(dá)腹膜巨噬細(xì)胞定義的基因。簇1表達(dá) Fcna (ficolin 1) ,Fn1(纖連蛋白1)和類視黃醇 X 受體 Rxra,并且通過流式細(xì)胞術(shù)主要位于 F4/80loMHCIIhi 區(qū)域(圖3C)。簇3表達(dá)更多的經(jīng)典腹膜駐留基因,包括 Ltbp1,Garnl3,Serpinb2,Alox15,Selp,F5,Timd4,Icam2(CD102)和 Gata6。通過流式細(xì)胞術(shù)定位于 F4/80hiMHCIIlo 區(qū)域的簇3(圖3C) ,其與 TIM4(Timd4)的表達(dá)一起表明簇1是轉(zhuǎn)變成簇3的單核細(xì)胞衍生的前體。簇4表達(dá)的基因通常在上皮細(xì)胞或間皮細(xì)胞(Krt18,Krt19,Msln,Wt1)中發(fā)現(xiàn),這表明它們可能是吞噬巨噬細(xì)胞。
最有趣的簇是簇2,它幾乎完全在 Trp53-/-,Pten-/-腫瘤中發(fā)現(xiàn)(圖3A 和 B) ,并且具有高表達(dá)的 HMOX1(Hmox1) ,這是一種酶,催化血紅素分解成一氧化碳,鐵(Fe2 +)和膽綠素。簇2還表達(dá)參與脂質(zhì)積累的基因,如 Trib3(Tribbles 假激酶 -3)和 Lgals3(半乳糖凝集素3) ,以及防止重金屬毒性的基因,如金屬硫蛋白 Mt1和 Mt2。簇2還表達(dá)了與免疫抑制相關(guān)的基因,包括 Cd274(PD-L1) ,Arg1(精氨酸酶1)和 Vegfa。通過流式細(xì)胞術(shù),簇2主要定位于 F4/80hiMHCIIlo 區(qū)域,表明它可能來源于腹膜巨噬細(xì)胞(圖3C)。我們使用 Monocle3進(jìn)行假時(shí)間分析來估計(jì)假定的分化方向。當(dāng)重新聚集時(shí),選擇第0組作為起始節(jié)點(diǎn),假時(shí)間預(yù)測(cè)第2組來源于第1組和第3組(圖3D) ,表明它代表腹膜駐留巨噬細(xì)胞的一個(gè)亞型。
我們通過流式細(xì)胞術(shù)在早期(進(jìn)行腹水形成)和晚期(存在腹水)時(shí)間點(diǎn)證實(shí)了這些巨噬細(xì)胞亞群的存在(圖3E 和 F)。這證實(shí)了在 Trp53-/-; Pten-/-腫瘤中早期存在簇2巨噬細(xì)胞(定義為 Arginase1+ PD-L1+ 或 HMOX1hi) ,并且在晚期腫瘤中顯著增加(圖3G 和 H)。我們還使用 IHC 驗(yàn)證了 ID8網(wǎng)膜腫瘤切片中 HMOX1+ 細(xì)胞的存在(圖3I) ,其中它們?cè)谥炯?xì)胞周圍和腫瘤邊界中被觀察到(圖3J)。
我們接下來評(píng)估了 HMOX1在簇2中表達(dá)的選擇性。使用 Hmox1GFP 轉(zhuǎn)基因小鼠,我們證實(shí)只有單核細(xì)胞和巨噬細(xì)胞表達(dá) HMOX1(圖3K)。盡管 LYVE1 + 間皮細(xì)胞襯里群體(占總巨噬細(xì)胞的一小部分)具有最高的表達(dá),但是簇2(精氨酸酶1 + PD-L1 +)高度表達(dá) HMOX1,其次是 CD102 + 腹膜巨噬細(xì)胞。CD11c + MHCIIhi 單核細(xì)胞來源的巨噬細(xì)胞和單核細(xì)胞表達(dá)較弱,其他群體表達(dá)較弱或不表達(dá)。當(dāng)組合時(shí),我們的數(shù)據(jù)顯示精氨酸酶1 + PD-L1 + HMOX1hi 巨噬細(xì)胞在 Trp53-/-; Pten-/-腫瘤中顯著富集(圖3L)。
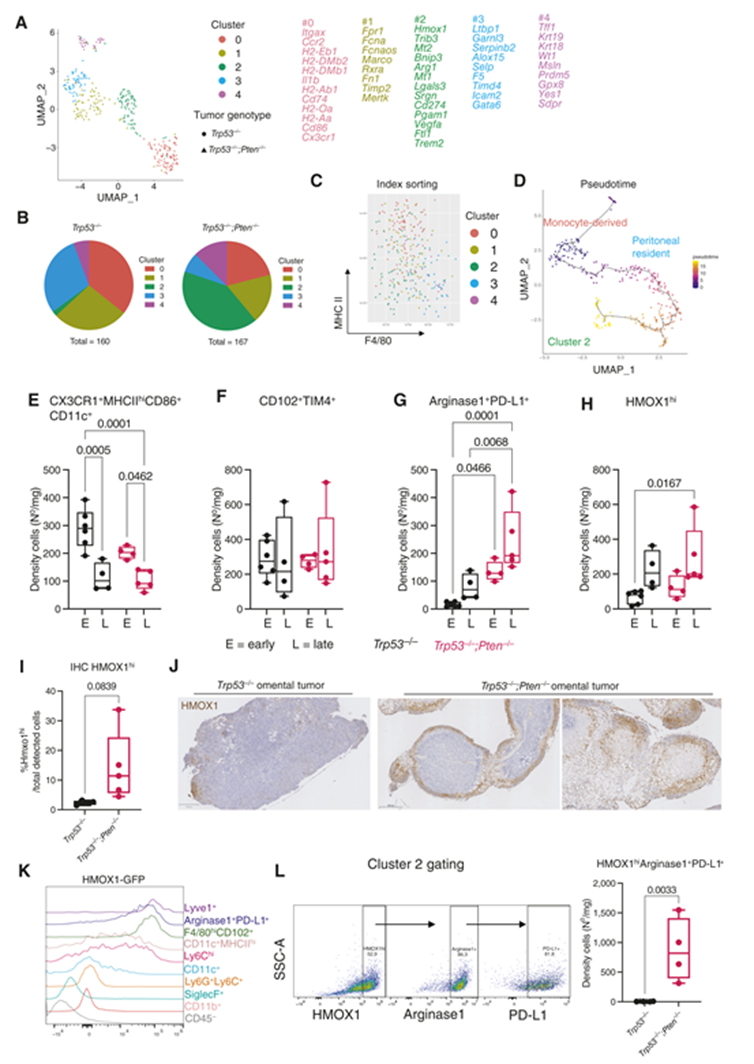
Figure 3 Pten-null的腫瘤細(xì)胞增強(qiáng)了網(wǎng)膜內(nèi)駐留樣巨噬細(xì)胞的積累
4. HMOX1hi 巨噬細(xì)胞來源于腹腔液巨噬細(xì)胞
為了檢驗(yàn)腹腔液駐留巨噬細(xì)胞是 HMOX1hi 巨噬細(xì)胞的主要來源的假設(shè),我們首先在 ID8細(xì)胞注射后24小時(shí)或13天將 AT CD45.1+ 腹腔液細(xì)胞(包括單核細(xì)胞,單核細(xì)胞來源的和駐留巨噬細(xì)胞)轉(zhuǎn)化為 CD45.2+ 小鼠。在網(wǎng)膜腫瘤中檢測(cè)到 CD45.1+ 細(xì)胞,證明腹腔液和腫瘤之間可以發(fā)生運(yùn)輸(圖4A)。有趣的是,駐留的 CD45.1+ F4/80hiMHCIIlo 細(xì)胞富含 Trp53-/-; Pten-/-腫瘤(圖4B 和 C,左) ,并相應(yīng)地在腹水中耗盡(圖4B 和 C,中)。大多數(shù) CD45.1+ 巨噬細(xì)胞是 TIM4+ ,表明長(zhǎng)期居住(圖4B 和 C,右)。為了進(jìn)一步確定 HMOX1hi 巨噬細(xì)胞是否可以來源于腹腔液,我們將來自健康 HMOX1GFP 小鼠的腹腔液 F4/80hiCD102+ 細(xì)胞分選并將其 AT 到攜帶 Trp53-/-; Pten-/-腫瘤的 HMOX1wt 同窩仔鼠中(圖4D)。我們?cè)?/span> Trp53-/-; Pten-/-網(wǎng)膜腫瘤(圖4E)中檢測(cè)到 HMOX1GFP 細(xì)胞,其表型復(fù)制宿主自身的群體(CD11c-MHCIIlo,CD102+ 精氨酸酶1+)并且?guī)缀跬耆珌碜蚤L(zhǎng)期駐留的 CD102+ TIM4+ 細(xì)胞(圖4F)。然而,宿主巨噬細(xì)胞庫中的一部分 CD102-細(xì)胞具有高精氨酸酶1和 PD-L1表達(dá)(圖4G 和 H) ,表明一些簇2巨噬細(xì)胞也可能來源于非 CD102+ 腹膜液細(xì)胞。
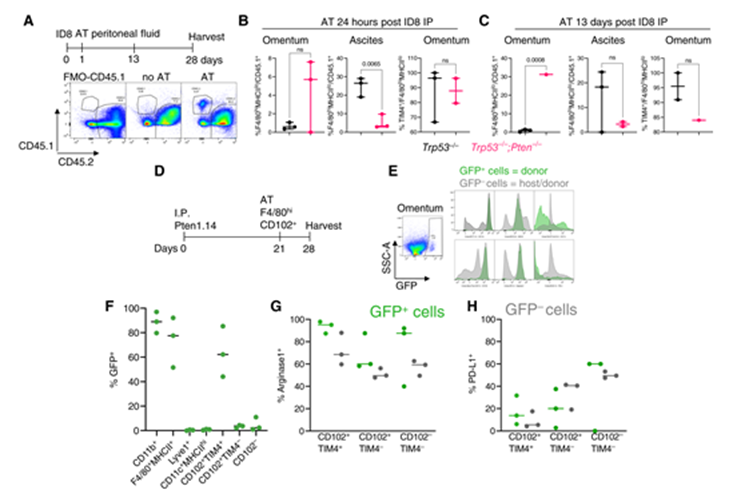
Figure 4 HMOX1hi 巨噬細(xì)胞部分來源于腹腔液巨噬細(xì)胞
5. HMOX1抑制延長(zhǎng)生存期
為了了解 HMOX1是否是 HGSC 潛在的治療靶點(diǎn),我們使用了 HMOX1抑制劑中卟啉錫(SnMP; ref)。SnMP 處理不影響 MHCIIhiCD11c+ 單核細(xì)胞衍生的或 CD102+ F4/80hi 巨噬細(xì)胞的網(wǎng)膜密度(圖5A 和 B) ,但確實(shí)增加了精氨酸酶1+ PD-L1+ HMOX1+ 巨噬細(xì)胞的密度(圖5C)。這可能是對(duì) HMOX1抑制反應(yīng)的補(bǔ)償機(jī)制,因?yàn)橐阎?/span> SnMP 刺激 HMOX1上調(diào),同時(shí)仍然阻斷酶活性。有趣的是,HMOX1抑制消耗了 LYVE1+ 巨噬細(xì)胞(圖5D) ,這表明它們對(duì)血紅素誘導(dǎo)的毒性敏感,與它們接近腫瘤脈管系統(tǒng)一致。SnMP 治療14天可減少腹水形成,但無顯著性差異(P = 0.078; 圖5E)。然而,延長(zhǎng)的 SnMP 作為5天/2天休息制度給予,顯著增加了 Trp53-/-; Pten-/-荷瘤小鼠的存活(危險(xiǎn)比0.32,95% CI,0.11-0.94,P = 0.002; 圖5F)。
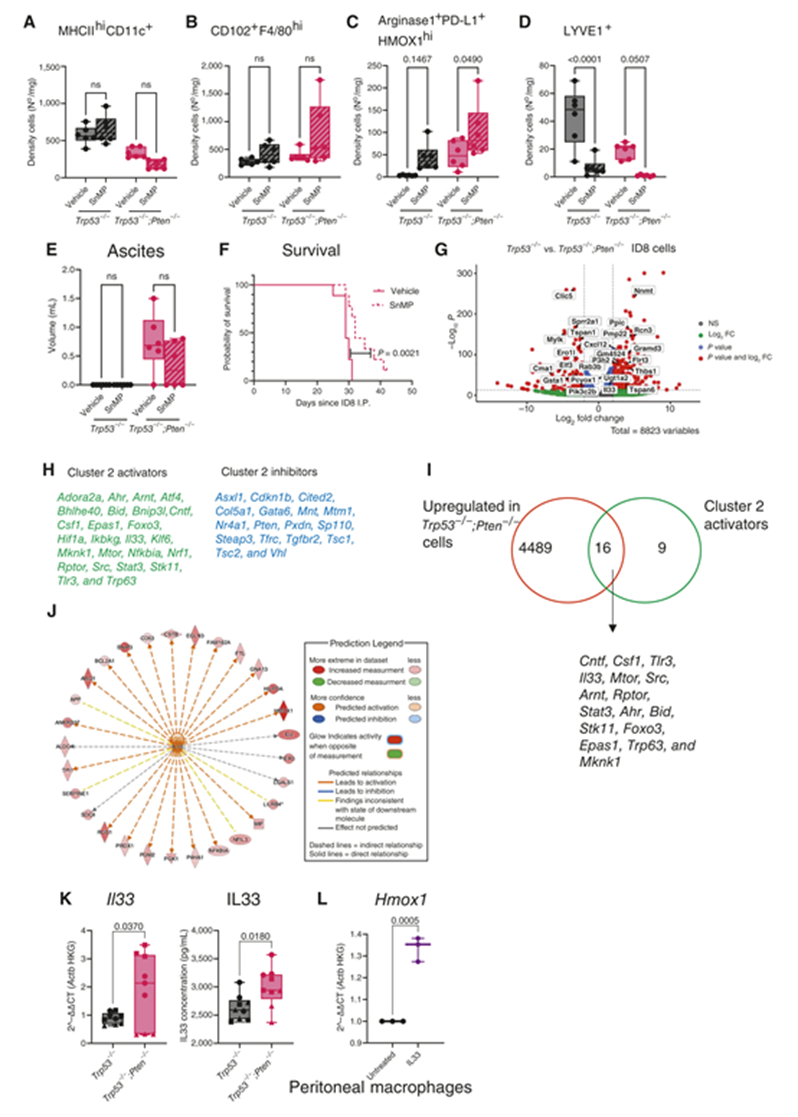
Figure 5 HMOX1抑制延長(zhǎng)攜帶 Pten-null ID8腫瘤的小鼠的存活
6. IL33作為簇2巨噬細(xì)胞的潛在驅(qū)動(dòng)因素
為了確定 Pten-null腫瘤細(xì)胞如何驅(qū)動(dòng)巨噬細(xì)胞擴(kuò)增,我們最初篩選了趨化因子和細(xì)胞因子的表達(dá)。這表明在一些 Pten-null細(xì)胞中 Ccl2和 Ccl7的表達(dá)顯著增加,但不在另外缺乏 Brca2的細(xì)胞中。我們還分析了視黃酸產(chǎn)生酶 Raldh1,2和3的表達(dá),因?yàn)楦鼓ず途W(wǎng)膜駐留巨噬細(xì)胞由視黃酸支持,其驅(qū)動(dòng)其駐留基因表達(dá)程序,包括 Gata6。然而,通過 Pten 缺失,Raldh1的表達(dá)并沒有持續(xù)改變。而 Raldh2和3在所有細(xì)胞中的表達(dá)可以忽略不計(jì)。此外,Trp53-/-; Pten-/-細(xì)胞沒有表現(xiàn)出增強(qiáng)的募集骨髓來源的巨噬細(xì)胞的能力,而 Ccr2的缺失導(dǎo)致骨髓來源的巨噬細(xì)胞向兩種基因型的募集減少。PTEN 缺失可以驅(qū)動(dòng)前列腺癌中 IL6的產(chǎn)生。然而,在 Trp53-/-; Pten-/-ID8細(xì)胞(CT 值)中 Il6表達(dá)較弱,克隆之間沒有統(tǒng)計(jì)學(xué)差異,盡管 IL6蛋白不能被 ELISA 檢測(cè)到。編碼血管內(nèi)皮生長(zhǎng)因子的 Vegfa 也沒有受到 Pten 丟失的影響。綜上所述,這些數(shù)據(jù)表明,一個(gè)或多個(gè)超越 Ccl2和 Ccl7的因子在體內(nèi)產(chǎn)生,支持駐地巨噬細(xì)胞的募集和擴(kuò)張。簇2的基因特征使我們能夠進(jìn)一步剖析 HMOX1hi 巨噬細(xì)胞的潛在驅(qū)動(dòng)因素。我們首先分析了 Trp53-/-; Pten-/-ID8細(xì)胞的大量 RNA-seq 分析。使用這種方法,我們發(fā)現(xiàn)與 Trp53-/-ID8細(xì)胞相比,Trp53-/-; Pten-/-中有4,505個(gè)基因顯著上調(diào)(圖5G)。使用 IPA (圖5H) ,我們鑒定了簇2的25個(gè)潛在的上游調(diào)節(jié)因子,其中16個(gè)與 Pten 無效細(xì)胞中也上調(diào)的基因重疊(圖5I)。在這些基因中,我們將 Il33鑒定為刺激簇2基因表達(dá)的可能候選基因,因?yàn)樗仁欠置谝蜃樱诸A(yù)測(cè)激活簇2中最大的基因組之一(圖5J)。我們證實(shí)在 Pten 缺失的 ID8系中 Il33基因和 IL33蛋白表達(dá)增加(圖5K)。然后我們?cè)?/span> IL33存在下培養(yǎng)腹腔液駐留巨噬細(xì)胞,觀察到 Hmox1基因表達(dá)顯著增加(圖5L)。
7. 小鼠和人類 HMOX1hi 巨噬細(xì)胞具有共同的特征
為了確保我們的小鼠數(shù)據(jù)與 HGSC 患者相關(guān),我們分析了一個(gè)大型 scRNA-seq 數(shù)據(jù)集,其中包含來自42名新診斷的初治 HGSC 患者的160個(gè)活組織檢查的數(shù)據(jù)。腫瘤相關(guān)巨噬細(xì)胞(n = 166,895)基于已知的標(biāo)記基因(包括 PTPRC,CD14,FCER1G 和 CD68)進(jìn)行注釋。我們首先根據(jù) HMOX1表達(dá)對(duì)人巨噬細(xì)胞進(jìn)行分類,將 HMOX1表達(dá)大于平均值1SD 的巨噬細(xì)胞定義為 HMOX1hi (圖6A)。然后我們比較了 HMOX1hi 巨噬細(xì)胞和每個(gè)小鼠群的 DEG。簇2顯示 HMOX1hi 細(xì)胞中重疊基因(n = 39)最多(圖6B)。同樣,在 HMOX1hi 巨噬細(xì)胞的87 DEG 中,最高比例(44.8% ,n = 39/87) 與簇2共享。HMOX1hi 巨噬細(xì)胞富含駐留巨噬細(xì)胞(LYVE1) ,血紅素代謝(BLVRB) ,細(xì)胞對(duì)缺氧(HILPDA) ,金屬硫蛋白(MT1E,MT1F,MT1G,MT1H 和 MT1M) ,鐵轉(zhuǎn)運(yùn)蛋白,儲(chǔ)存和體內(nèi)平衡(SLC40A1,HAMP,FTH1和 FTL)和脂質(zhì)代謝和儲(chǔ)存(APOC1,PLIN2和 LIPA; 圖6C)。相反,HMOX1lo 巨噬細(xì)胞富含干擾素 γ 應(yīng)答基因(CXCL9和 CXCL10) ,免疫細(xì)胞和 T 細(xì)胞募集基因(CCL5,CXCL9,CXCL10,CXCL11和 IL1B)和 MHCII 基因(HLA-DQA1; 圖6C)。對(duì) HMOX1hi 巨噬細(xì)胞轉(zhuǎn)錄組的 MSigDB富集分析揭示了在小鼠簇2中也發(fā)現(xiàn)的缺氧反應(yīng),離子穩(wěn)態(tài),脂質(zhì)代謝和 mTORC1信號(hào)傳導(dǎo)途徑的富集(圖6D)。因此,人類 HGSC 包含一組巨噬細(xì)胞,它們與小鼠簇2具有共同的特征,并且具有高 HMOX1表達(dá)、組織駐留、擁有屬性氧化應(yīng)激反應(yīng)和低促炎細(xì)胞因子/趨化因子表達(dá)。
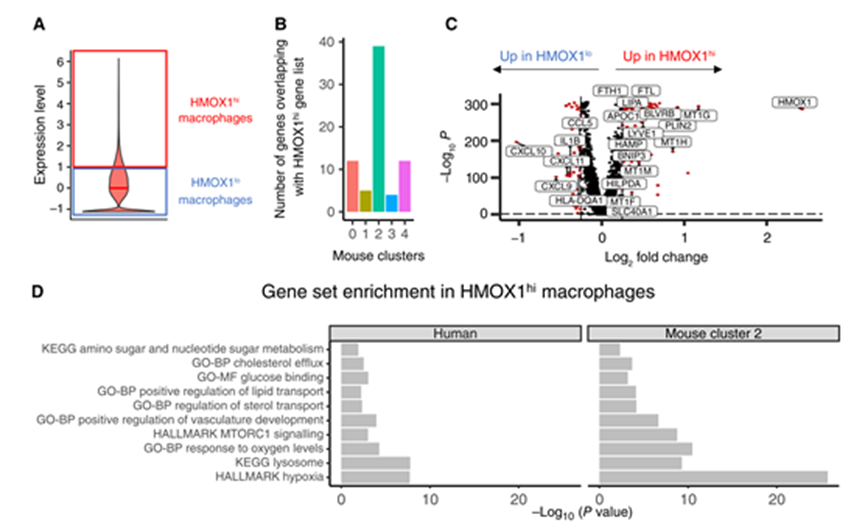
Figure 6 小鼠和人 HMOX1hi 巨噬細(xì)胞在 HGSC 中具有共同的特征
8. HMOX1hi 巨噬細(xì)胞與 HGSC 中 OS 和 PI3K 信號(hào)通路激活的關(guān)系
在小鼠中,簇2巨噬細(xì)胞幾乎只在 Pten-null腫瘤中發(fā)現(xiàn)(圖3A 和 B)。在 scRNA-seq 數(shù)據(jù)集中,來自富含 HMOX1hi 巨噬細(xì)胞的腫瘤的癌細(xì)胞。S8A 表現(xiàn)出高 mTOR 信號(hào)傳導(dǎo)和高胰島素樣生長(zhǎng)因子信號(hào)傳導(dǎo)(圖7A) ,可激活 PI3K/AKT 信號(hào)傳導(dǎo)。相比之下,HMOX1hi 巨噬細(xì)胞富集的腫瘤中免疫相關(guān)通路下調(diào)(圖7A)。
在 BriTROC-1研究中,來自172名患者的診斷性 HGSC 樣品上的 IHC 表現(xiàn)出 HMOX1和 CD68之間的強(qiáng)相關(guān)性(圖7B 和 C) ,使我們能夠使用高 HMOX1表達(dá)作為 HMOX1hi 巨噬細(xì)胞的替代物。HMOX1hi 巨噬細(xì)胞的存在與腫瘤細(xì)胞中陽性 pAKT (S473)染色呈正相關(guān),盡管很弱(圖7D 和 E)。S8B) ,并且在調(diào)整年齡和分期后也與 BriTROC-1患者的生存率降低獨(dú)立相關(guān)[ HR = 1.80(1.07-3.0) ; 圖7F 和 G ]。高 HMOX1表達(dá)對(duì)預(yù)后的影響在 mRNA 水平的單獨(dú)驗(yàn)證隊(duì)列中得到證實(shí)。
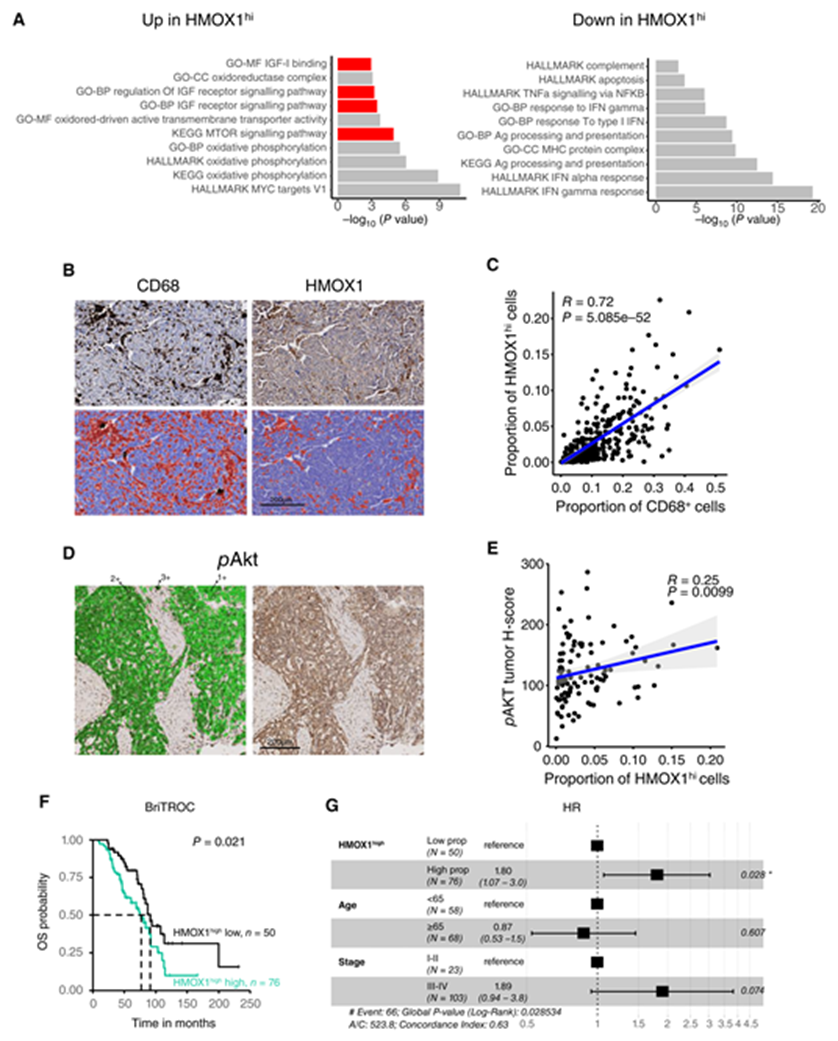
Figure 7 高比例的 HMOX1hi 巨噬細(xì)胞與較差的 OS 和 PI3K 信號(hào)通路激活有關(guān)
研究結(jié)論
總之,我們已經(jīng)表明 HMOX1hi 巨噬細(xì)胞具有常見的基因表達(dá)程序,包括免疫抑制,缺氧,膽固醇流出和脂質(zhì)轉(zhuǎn)運(yùn),可以在小鼠和人類 HGSC 中鑒定。HMOX1hi 巨噬細(xì)胞在 HGSC 中的功能仍有待充分了解,基因表達(dá)途徑可能反映了誘導(dǎo) HMOX1hi 細(xì)胞的 PI3K 驅(qū)動(dòng)的微環(huán)境和整體巨噬細(xì)胞功能。盡管如此,我們的研究強(qiáng)調(diào) HMOX1抑制可能為 HGSC 提供相關(guān)的治療策略。
研究方法:
細(xì)胞培養(yǎng),RNA 提取和 cDNA 合成,SMART-Seq2 單細(xì)胞 RNA 測(cè)序,CD45.1 采血轉(zhuǎn)移,HMOX1GFP 巨噬細(xì)胞采血轉(zhuǎn)移,腹腔常駐巨噬細(xì)胞體外刺激,單細(xì)胞 RNA 測(cè)序數(shù)據(jù)分析,ID8 批量 RNA 測(cè)序數(shù)據(jù)分析,HMOX1 在獨(dú)立驗(yàn)證隊(duì)列中的診斷價(jià)值,統(tǒng)計(jì)分析。
參考文獻(xiàn):
Spear S, Le Saux O, Mirza HB, Iyer N, Tyson K, Grundland Freile F, Walton JB, Woodman C, Jarvis S, Ennis DP, Aguirre Hernandez C, Xu Y, Spiliopoulou P, Brenton JD, Costa-Pereira AP, Cook DP, Vanderhyden BC, Keun HC, Triantafyllou E, Arnold JN, McNeish IA. PTEN Loss Shapes Macrophage Dynamics in High-Grade Serous Ovarian Carcinoma. Cancer Res. 2024 Nov 15;84(22):3772-3787. doi: 10.1158/0008-5472.CAN-23-3890IF: 12.5 Q1 . PMID: 39186679IF: 12.5 Q1 ; PMCID: PMC7616669IF: 12.5 Q1 .






