膠質瘤來源的ANXA1通過促進抗炎腫瘤微環境抑制對TLR3配體的免疫應答
高度免疫抑制性腫瘤微環境(TME)和血腦屏障的存在是高級別膠質瘤(HGG)患者誘導有效免疫應答的兩大障礙。在本注冊臨床試驗(NCT03392545)中,作者試圖通過顱內注射poly(I:C)增強復發性HGG患者的局部固有免疫應答,以建立強大的抗腫瘤免疫應答。在隨訪過程中,12例(44.4%)患者達到腫瘤控制和生存獲益,被認為是本研究的反應者。作者發現poly(I:C)處理后,TME中的T細胞受體(TCR)譜發生了重塑。基于腫瘤樣本的RNA-seq分析,膜聯蛋白A1(ANXA1)在無反應患者的腫瘤細胞中表達顯著上調,并在蛋白水平進一步驗證。體內外實驗表明,ANXA1通過其表面受體甲酰肽受體1(FPR1)誘導M2樣巨噬細胞和小膠質細胞產生,建立Treg細胞驅動的免疫抑制性TME,并抑制poly(I:C)促進的抗腫瘤免疫應答。ANXA1/FPR1信號軸可通過促進抗炎和Treg驅動的TME抑制膠質瘤患者的固有免疫反應。ANXA1可作為poly(I:C)治療反應的可靠預測因子,預測準確率達92.3%。鑒于這些顯著的發現,本研究揭示了膠質瘤免疫治療的新視角。本文于2023年12月發表于《Cellular & molecular immunology》,IF: 24.1;Q1。
技術路線:

主要實驗結果:
1、HGG患者的治療和預后
本研究納入了一個包含27例患者的隊列。在術前和術后階段進行了全面的采樣程序,以獲取腫瘤樣本、腦脊液(CSF)和外周血(圖1A)。從北京天壇醫院獲取患者的基因及臨床資料。
在27例患者中,1例(3.7%)達到完全緩解(CR),9例(33.3%)達到部分緩解(PR),2例(7.4%)達到疾病穩定(SD),15例(55.6%)達到疾病進展(PD),因此疾病控制率為44.4%(圖1B)。將達到CR、PR或SD的患者定義為有反應者,而出現PD的患者定義為無反應者。有反應者的中位無進展生存期和總生存期分別為221.0天和441.0天,顯著長于無反應者(P < 0.05)(圖1C和D)。
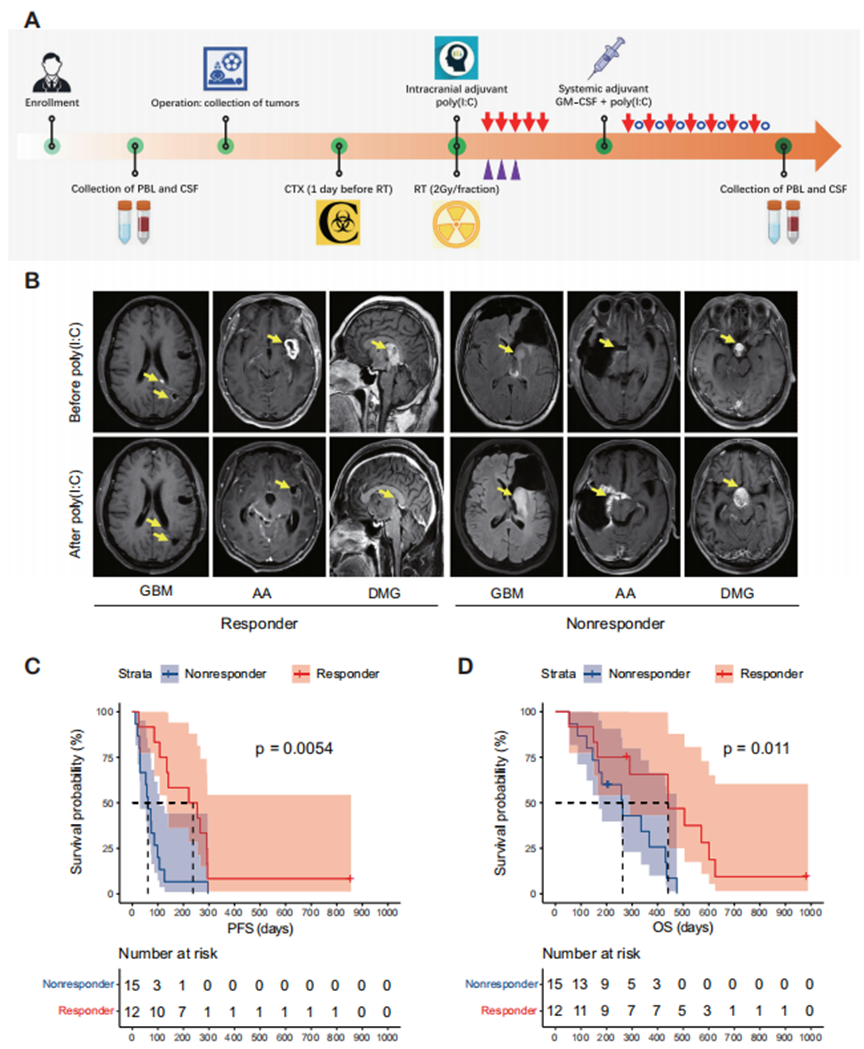
圖1 免疫佐劑poly(I:C)治療為應答者提供了生存獲益
2、應答者的CSF和TILs中存在CTLs的優勢寡克隆
為了評估poly(I:C)治療后反應組和無反應組患者TME中細胞毒性T淋巴細胞(CTLs)增殖的潛在差異,作者分析了兩組患者在poly(I:C)治療前后CSF、外周血淋巴細胞(PBLs)和腫瘤浸潤淋巴細胞(TILs)的TCR譜模式。發現CSF中可能發生了一些優勢克隆的擴增,最終導致CSF中細胞數量增加,而不影響TCR克隆型。
進一步分析各組間CSF和PBLs中所有克隆型TCRs的比例。CSF內TCR多樣性的變化顯示出有應答組和無應答組之間的顯著差異,而這一趨勢在PBLs分析中消失(圖2A)。在應答者的CSF中,占總克隆空間5%以上的超擴增克隆型特異性富集(圖2B)。作者進一步分析了前10個TCR克隆在應答者和無應答者之間的比例,發現擴增最多的克隆型在應答者CSF中占據了顯著更大的克隆空間百分比(圖2C)。正如預期的那樣,部分CTL克隆在CSF和TILs中強勁增殖發生于有應答者,而非無應答者(圖2D)。此外,在接受poly(I:C)治療后,高度豐富的克隆型僅在有應答者的TILs中顯著富集,而在無應答者的TILs中未顯著富集(圖2E),這表明局部腫瘤中的T細胞庫發生了重塑。
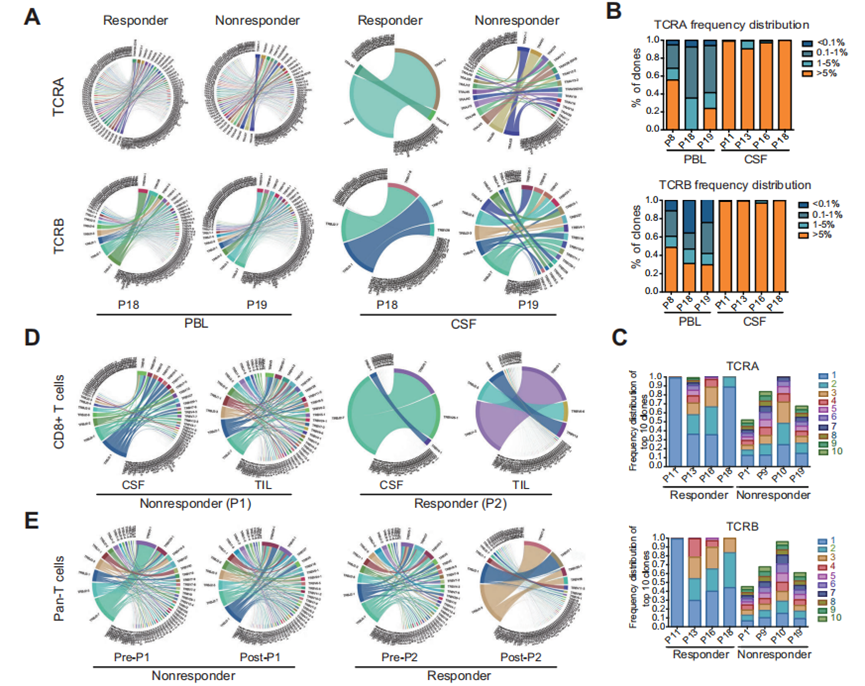
圖2 對poly(I:C)應答組和無應答組之間配對CSF和PBL樣本的TCR多樣性分析
3、無應答者的TME以Treg細胞為主
由于應答者表現出優勢的CTL增殖,作者使用scRNA-seq和配對TCR-seq擴展了TILs中CD45+免疫細胞的特征。作者最初通過無監督聚類法在2個樣本中識別出10個不同的T細胞簇(圖3A)。CD8+和CD4+ T細胞表現為表達na?ve標志物(SELL和CCR7)、活化效應標志物(GZMA、GZMH和GZMK)或耗竭標志物(PDCD1和HAVCR2)的亞群。此外,Treg細胞表達CD4和FOXP3(圖3B)。接下來的聚類分析表明,無應答者的TCR克隆主要是CD4+ Treg細胞和耗竭的CD4+細胞,而有應答者的TCR克隆主要是記憶性和效應性T細胞(圖3C)。作者進一步將免疫細胞分為三個主要亞組(Treg細胞、非Treg CD4+細胞和CD8+細胞),發現Treg細胞在無應答者的腫瘤中占優勢,而CD8+細胞在有應答者的腫瘤中富集(圖3D)。有趣的是,根據治療前后樣本中TCR比率的變化,結合從緩解后復發腫瘤中獲得的scRNA-seq數據,作者發現,在無反應者的治療后腫瘤中比例增加的克隆最終退化為耗竭和Treg CD4+細胞(圖3E)。而緩解組患者治療后腫瘤中高比例和遞減比例的克隆主要為CTLs,且多為復發后的效應性、記憶性和耗竭性CD8+細胞(圖3F)。這些結果表明,無應答患者增加的Treg細胞產生了免疫抑制性TME。
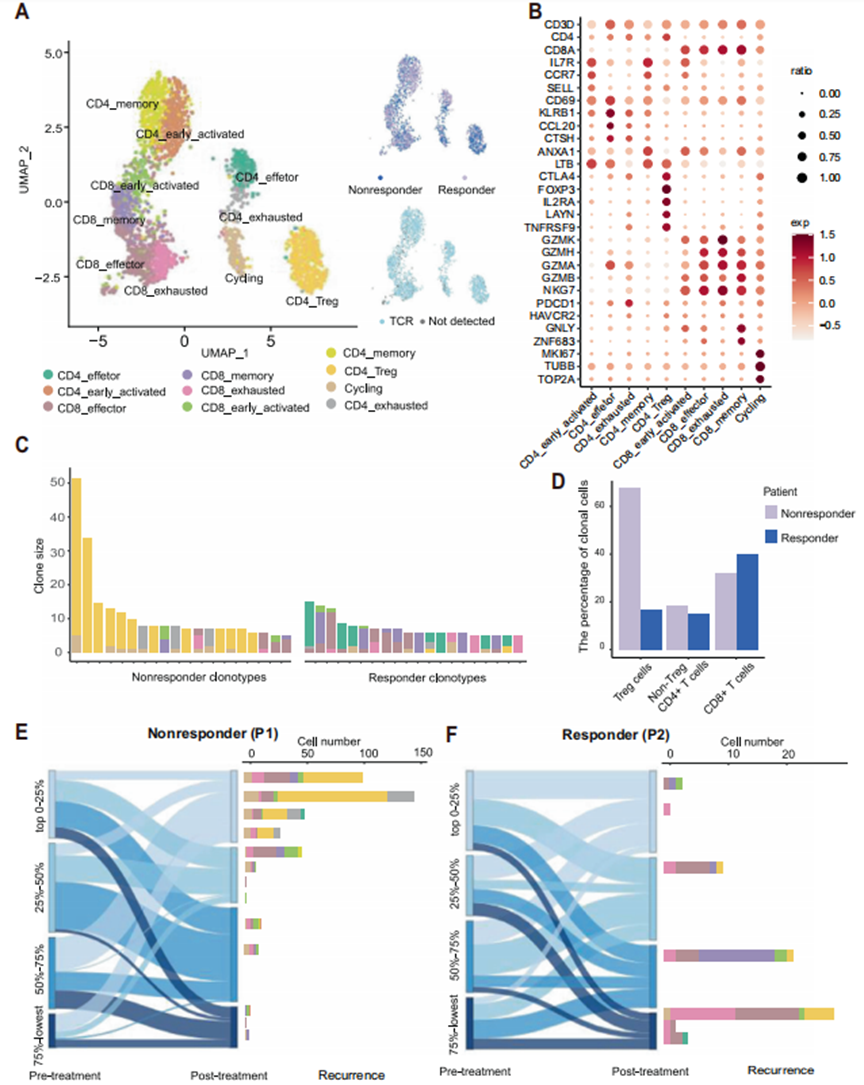
圖3 scRNA-seq分析揭示無應答者保留了以Treg細胞為主的腫瘤微環境
4、無應答者可促進過度炎癥性TME
為進一步研究產生這種不同治療應答的原因,并確定對poly(I:C)產生應答的預測因素,作者對應答者和無應答者的6個治療前樣本的轉錄組進行了測序。對差異表達基因的功能富集分析顯示,在無應答者中,許多參與適應性和固有免疫的免疫相關基因模塊上調(圖4A和B)。此外,無應答者中大多數下調的模塊與神經發育功能相關(圖4C和D)。
為了更好地了解無應答患者的特征,作者系統分析了癌癥基因組圖譜(TCGA)數據庫中作為對照的5例癌旁正常組織(GBM)樣本、2例有應答的復發患者樣本的轉錄組數據和既往測序數據。綜合分析表明,治療前應答組樣本的基因表達模式與癌旁組樣本相似,而復發應答組樣本的特征介于應答組和無應答組之間(圖4E-G)。這一發現提示了患者從免疫應答到無應答的轉錄特征逐漸轉化。值得注意的是,與其他患者的樣本相比,在無應答者的樣本中,免疫相關模塊顯著上調(圖4F)。這些發現提示無反應患者的TME與過度激活和過度炎癥相關。
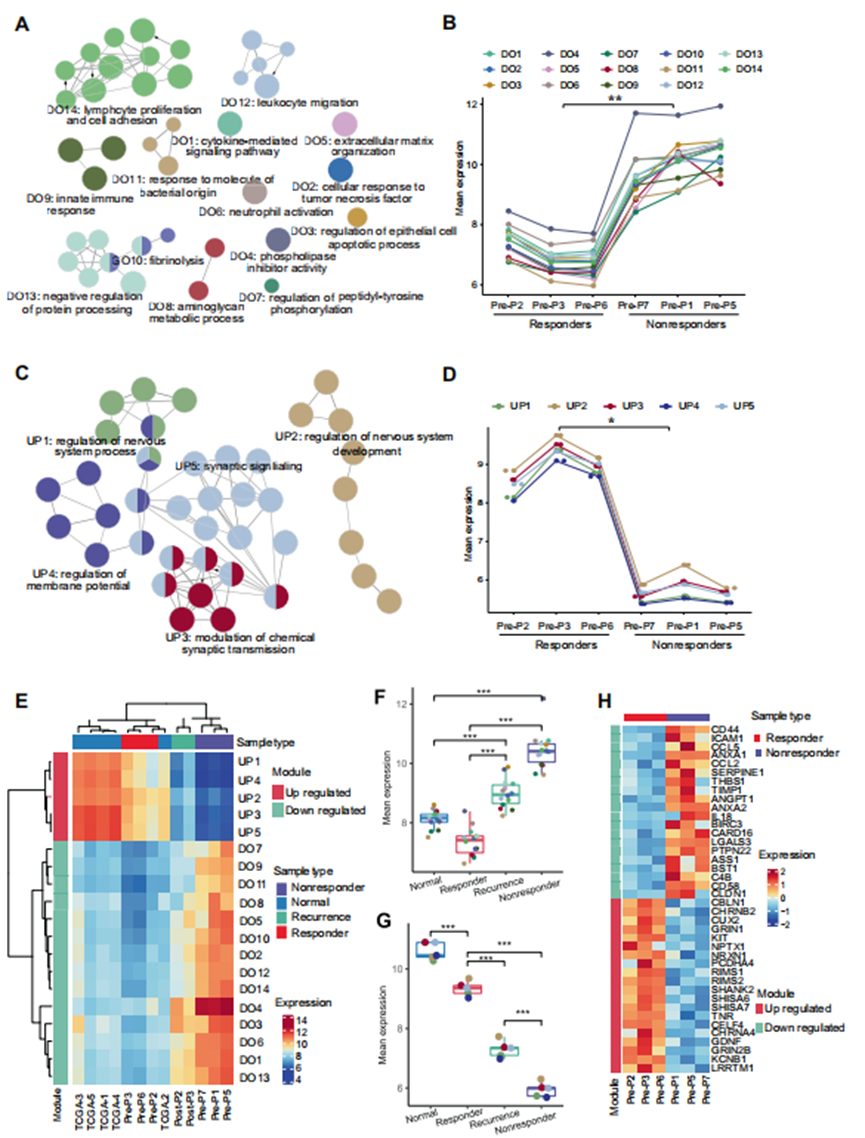
圖4 應答者和無應答者之間轉錄組譜的差異
5、ANXA1是TLR3配體應答的潛在預測因子
通過差異表達分析,作者確定了上調或下調的前20個差異表達基因(圖4H)。通過定量PCR驗證,作者發現有應答者和無應答者之間的ANXA1水平顯著不同(圖5A)。因此,作者后續的分析集中在ANXA1上。通過比較ANXA1在4組(癌旁組、無應答組、有應答組和有應答的復發組)中的表達水平,作者發現ANXA1在無應答組中表達最高,其次是在正常組和有應答組中表達較低(圖5B)。免疫組化數據還表明,ANXA1在無應答者的腫瘤中高表達,并且其表達在應答組中非常低,但在復發組中升高(圖5C)。此外,作者根據TCGA和GTEx數據庫添加了數百個膠質瘤腫瘤和對照正常組織之間的樣本中ANXA1的表達。分析結果顯示,ANXA1在膠質瘤中的表達水平顯著高于正常組織。通過回顧性分析接受poly(I:C)治療的患者中ANXA1蛋白的表達,探討ANXA1作為TLR3配體治療應答預測因子的有效性。作者的結果表明,有應答者的ANXA1表達顯著低于無應答者。受試者工作特征(ROC)曲線顯示,ANXA1預測TLR3配體應答的敏感度、特異度和準確度分別為91.7%、92.9%和92.3%(圖5D)。
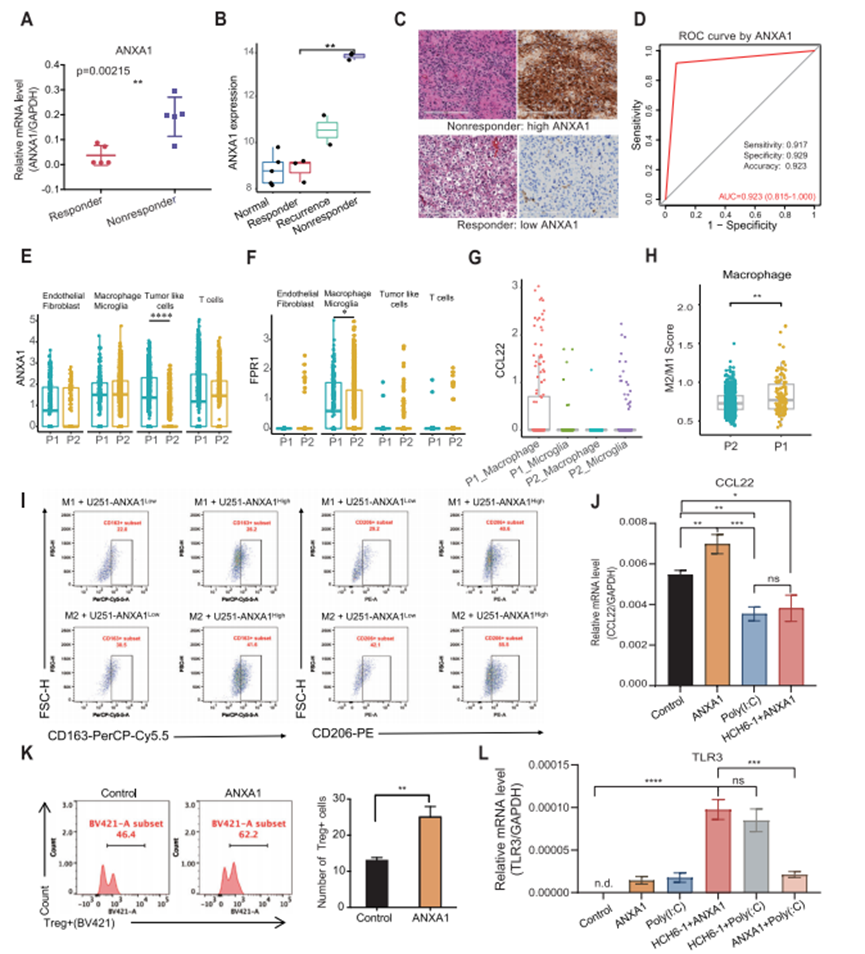
圖5 膠質瘤源性ANXA1誘導M2樣巨噬細胞募集Treg細胞
6、ANXA1可誘導巨噬細胞M2型極化
雖然ANXA1在細胞中廣泛表達,但根據單細胞數據,腫瘤細胞是應答者和無應答者之間不同表達模式的主要來源(圖5E)。FPR1作為ANXA1的主要受體,主要表達于無應答的小膠質細胞和巨噬細胞(圖5F)。這些結果提示腫瘤中巨噬細胞可能通過分泌一些趨化因子來招募Treg細胞。因此,作者通過單細胞RNA-seq測定了巨噬細胞中CCL22的表達,發現應答樣本中的CCL22表達顯著高于無應答樣本(圖5G)。既往研究表明M2型巨噬細胞募集更多的Treg細胞,因此作者評估了M2型相關基因在巨噬細胞中的表達。根據M1(IL6、IL1B、IL12B、CD86、CXCL9、CXCL10、IFNB1、IFNAR1和TNF)和M2(IL10、CCL22、ARG1、MRC1、CD163、MRC1、TGFB1、IRF4、TGM2、CXCL12和CXCR4)標記基因,作者對單細胞RNA-seq中的每個巨噬細胞進行了評分,并證實無應答(P1)樣本中的巨噬細胞顯示出更強的M2表型(圖5H)。
這一與腫瘤-巨噬細胞/小膠質細胞-Treg關系相關的見解促使作者探索ANXA1在調節巨噬細胞極化中的作用。在U251細胞與巨噬細胞共培養體系中,通過檢測巨噬細胞表面標志物CD163和CD206的表達來評估其M2型表型。流式細胞術檢測結果顯示,與U251-ANXA1High膠質瘤細胞共培養組的M2型巨噬細胞數量高于與U251-ANXA1Low膠質瘤細胞共培養組。這些結果共同支持ANXA1在觸發巨噬細胞M2表型極化中發揮關鍵作用的結論(圖5I)。此外,與未處理的巨噬細胞相比,重組人類ANXA1處理的巨噬細胞釋放更高水平的CCL22,而poly(I:C)顯著抑制ANXA1的誘導并進一步降低巨噬細胞中CCL22的表達。加入FPR1抑制劑HCH6-1可抑制ANXA1誘導的CCL22水平升高(圖5J)。
為了驗證ANXA1/FPR1軸在腫瘤細胞和巨噬細胞之間募集Treg細胞的功能,作者進行了Treg趨化實驗,結果表明ANXA1處理的M2巨噬細胞比未處理的M2巨噬細胞募集更多的Treg細胞(圖5K)。這些結果表明ANXA1可以顯著增強巨噬細胞募集Treg細胞的能力。
此外,poly(I:C)刺激后,M0細胞中TLR3的mRNA表達顯著激活,加入FPR1抑制劑HCH6-1后,激活效率無明顯影響,但ANXA1與poly(I:C)共存導致TLR3下調(圖5L)。這一結果表明ANXA1通過下調其受體TLR3的表達來抑制對poly(I:C)的應答。
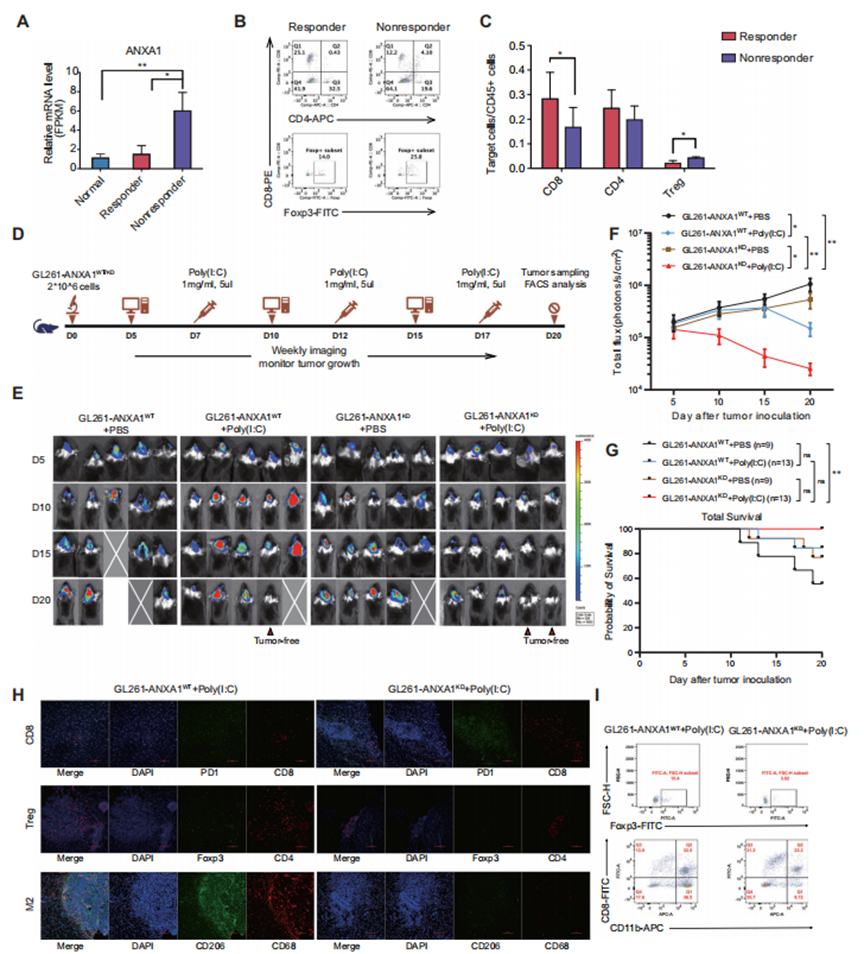
圖6 膠質瘤中ANXA1的低表達與原位腫瘤小鼠對TLR3配體的有效反應相關
7、降低ANXA1的表達可提高對TLR3配體的應答
作者使用GL261細胞建立原位腫瘤小鼠模型,研究ANXA1對TLR3配體的直接影響。對小鼠進行Poly(I:C)免疫治療。作者對腫瘤進行了RNAseq分析,發現poly(I:C)應答小鼠的ANXA1表達水平相對較低,這與正常小鼠腦組織中的ANXA1表達水平相似(圖6A)。為了確定該模型小鼠原位腫瘤中的腫瘤浸潤T細胞類型,作者分析了來自小鼠樣本的細胞,發現與無應答小鼠的腫瘤相比,CD8細胞在有應答小鼠的腫瘤中顯著富集。相反,無應答小鼠的Treg細胞水平高于有應答小鼠(圖6B和C)。為了進一步驗證ANXA1和TLR3配體之間的關聯,作者使用GL261-ANXA1WT-luc和GL261-ANXA1KD-luc細胞在小鼠中產生原位腫瘤,并給予poly(I:C)(圖6D)。GL261-ANXA1WT-luc細胞較GL261-ANXA1KD-luc細胞誘導更多的實質性腫瘤進展。此外,腫瘤中ANXA1的低表達導致了對poly(I:C)的有效應答,顯示了強大的腫瘤控制能力(圖6E和F)。此外,作者在所有實驗小鼠中進行了生存分析,結果顯示,接受poly(I:C)的ANXA1KD小鼠的生存時間顯著長于未注射poly(I:C)的ANXA1WT小鼠(P < 0.01)(圖6G)。雖然這些小鼠在第20天被殺死,但四組小鼠的生存趨勢仍然可以為干預的效果提供有價值的見解。作者分析了小鼠原位腫瘤的TILs,發現在poly(I:C)處理后,GL261-ANXA1KD-luc小鼠比GL261-ANXA1WT-luc小鼠激活了更多的CD8細胞。相反,在GL261-ANXA1WT-luc小鼠的腫瘤中,Treg細胞和M2巨噬細胞的水平高于GL261-ANXA1KD-luc小鼠的腫瘤(圖6H)。流式細胞術數據與多色IF染色結果一致(圖6I)。因此,作者的數據表明,ANXA1水平較低的腫瘤對TLR3配體有更有效的應答。
結論:
在本研究中,作者證明了膠質瘤來源的ANXA1對體內TLR3配體應答有重要影響,通過ANXA1/FPR1軸使巨噬細胞和小膠質細胞向M2樣表型傾斜,促進免疫抑制性TME的發展。作者的發現為ANXA1在膠質瘤生物學中的功能提供了更多的機制見解。首先,作者發現,如在對poly(I:C)有應答的患者中觀察到的那樣,無應答者在CSF或TILs中均不具有優勢寡克隆的特征。其次,作者發現在無反應的TME中,高炎癥和免疫抑制的TME伴隨著ANXA1的高表達被促進。第三,作者發現ANXA1高表達可以觸發巨噬細胞向M2表型極化,增強Treg細胞浸潤,降低患者和膠質瘤模型小鼠的生存率。作者的結果揭示了膠質瘤細胞通過ANXA1/FPR1軸調節腦腫瘤環境的機制,并有助于TLR3配體的治療抵抗。
綜上所述,作者提出了以下模型(圖7):在無應答膠質瘤中,ANXA1的高表達與巨噬細胞和小膠質細胞中FPR1的高表達相關,后者可以通過趨化釋放抗炎細胞因子來招募Treg細胞;因此,以Treg細胞為主的免疫細胞群建立了免疫抑制性TME。與此模型一致,TME抑制了poly(I:C)的免疫激活,臨床表現為對poly(I:C)的抵抗。ANXA1被認為是一個可靠的預測對TLR3配體反應的指標,因為它在腫瘤組織樣本中有應答和無應答之間的差異表達。從臨床角度來看,評估TLR3配體(如poly(I:C))的治療效用可能是有趣的,同時重點關注通過穿刺活檢確定的膠質瘤腫瘤組織中ANXA1表達水平與癌旁組織相似或略低的患者人群。這種方法有助于制定個性化的免疫治療方案。對于無應答者,FPR1阻滯劑可能克服poly(I:C)耐藥,但仍需要臨床試驗的支持。探索和了解ANXA1在膠質瘤生物學中的分子機制,可拓寬TLR3配體應答者的靶人群,改善膠質瘤患者的預后。
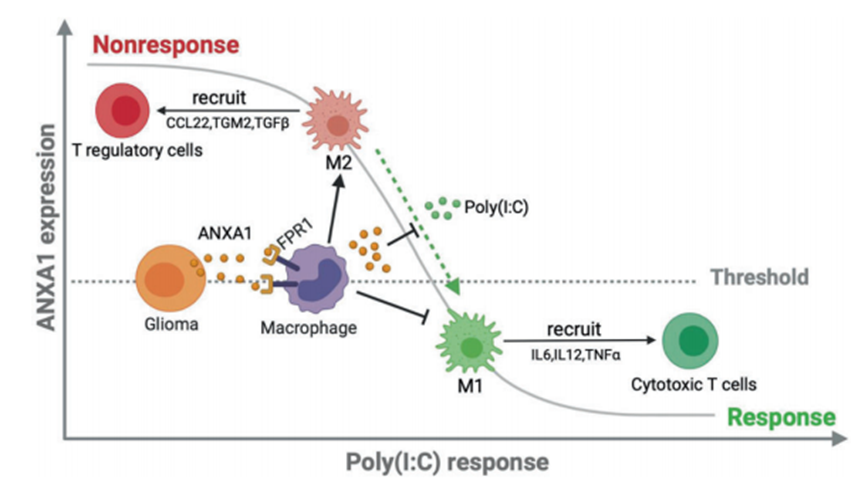
圖7 在膠質瘤的TME中,ANXA1/FPR1軸和TLR3配體觸發了抗腫瘤免疫應答
實驗方法:
制備單細胞懸浮液;CD8+CTLs TCR庫的建立與分析;單細胞RNA測序(scRNA-seq)和scRNA-seq數據處理;TCR測序(TCR-seq)數據處理;細胞間相互作用;RNA-seq數據分析及富集分析;組織切片和免疫組化(IHC);免疫熒光(IF);細胞系和培養條件;流式細胞術;趨化性實驗;小鼠模型。
參考文獻:
Zheng Y, Jiang H, Yang N, Shen S, Huang D, Jia L, Ling J, Xu L, Li M, Yu K, Ren X, Cui Y, Lan X, Lin S, Lin X. Glioma-derived ANXA1 suppresses the immune response to TLR3 ligands by promoting an anti-inflammatory tumor microenvironment. Cell Mol Immunol. 2023 Dec 4. doi: 10.1038/s41423-023-01110-0. Epub ahead of print. PMID: 38049523.






