增強子的舞臺?m6A的華麗舞伴
前列腺癌(PC)的骨轉移頻率最高,且對177Lu-前列腺特異性膜抗原(PSMA)放射性配體療法的耐藥性很強。目前人們對骨轉移性前列腺癌(mPCa)對放射治療的耐藥性知之甚少。該研究發(fā)現(xiàn)骨特異性m6A修飾的增強子RNA(eRNA)在調控mPCa進展和放療抵抗中發(fā)揮重要作用。本文于2023年1月發(fā)表在《Theranostics》IF:12.4期刊。
技術路線

主要實驗結果
1、在骨mPCa中鑒定特異性eRNA修飾
作者比較了有無化療的患者之間的存活情況以探究化療抵抗和骨mPCa患者之間的關系。結果發(fā)現(xiàn)PSMA放療延長原發(fā)PCa患者和淋巴結(LN)mPCa的存活時間,但是對骨mPCa的作用有限(附圖1A)。鑒于增強子和eRNA是組織特異性和功能特異性的元件,作者探索了骨mPCa中的特異性eRNA,并表征了表觀轉錄組的骨mPCa相關功能。在CRPC細胞中通過RNA-seq鑒定的100個差異上調的增強子轉錄本中,發(fā)現(xiàn)43個eRNA在骨mPCa PC3細胞中高表達(圖1A)。作者此前檢測m6A是否是致癌骨mPCa中eRNA的特異性修飾,發(fā)現(xiàn)通過兩種不同的m6A抗體結合MeRIP-seq免疫沉淀,發(fā)現(xiàn)6個帶有m6A信號的eRNA。隨后,通過基因間峰選擇和qPCR驗證篩選6個eRNA,結果在骨mPCa細胞中有一個獨特的m6A eRNA上調(圖1A-B)。對LNCaP和PC3細胞已發(fā)表的ChIP-seq數(shù)據(jù)的薈萃分析發(fā)現(xiàn),該區(qū)域是一個真正的增強子,表現(xiàn)為可富集增強子激活子(BRD4)、增強子標記物(H3K4me1和H3K27ac)和啟動子標記物(H3K4me3)(圖1B)。根據(jù)eRNA的命名規(guī)則,作者將該eRNA標記為MLXIPe,因為它與MLXIP mRNA接近。兩個推測的m6A位點(#1:TTACA chr12 122502280-122502284;#2: GGACA chr12 122506423-122506427)在MLXIPe中被兩個獨立的m6A抗體鑒定(圖1B)。
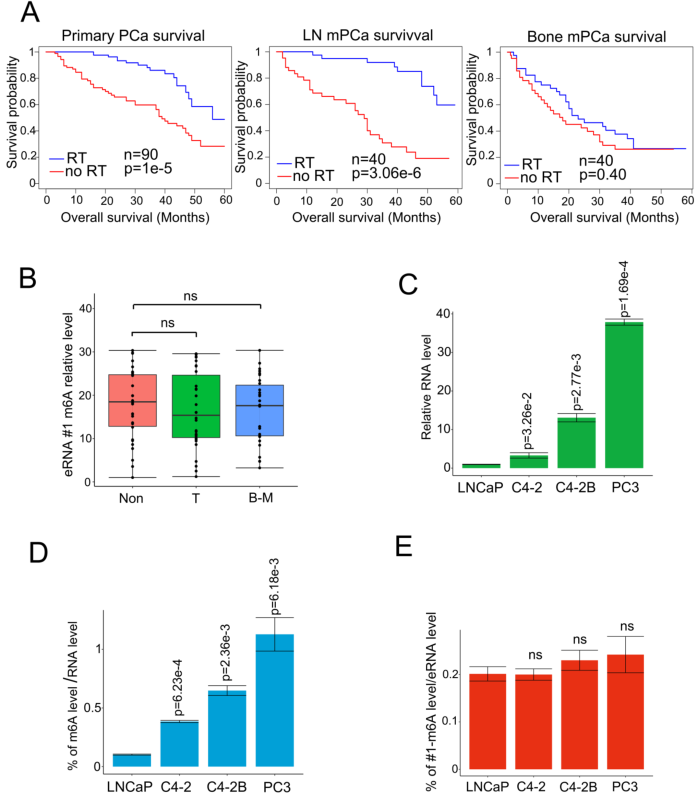
附圖1 MLXIPe的m6A是患者的不良預后因素
從原發(fā)性前列腺癌、鄰近正常前列腺組織和骨轉移癌的新鮮樣本中收集了m6A抗體免疫沉淀的RNA,以證明m6A修飾在臨床病理背景下的功能作用。箱形圖顯示,在該隊列中,骨mPCa樣本中MLXIPe的#2-m6A水平明顯高于原發(fā)性PCa或鄰近前列腺樣本(圖1C-D)。然而,在mPCa、原發(fā)性PCa和鄰近前列腺正常組織樣本之間,MLXIPe的#1-m6A水平無顯著差異(附圖1B)。此外,發(fā)現(xiàn)MLXIPe的#2-m6A水平在骨mPCa細胞系PC3和C4-2B中顯著升高(附圖1C-D),但MLXIPe的#1-m6A水平在所有細胞系中沒有差異(附圖1E)。在骨轉移隊列中,進一步確定MLXIPe #2-m6A水平與PCa患者臨床特征的生存意義。Kaplan-Meier生存分析發(fā)現(xiàn),在骨mPCa患者中,MLXIPe的RNA和m6A水平升高與較短的生存期相關(圖1E-F)。PET分析顯示,在前列腺癌患者73 (P-73) mlxipe - m6low中,遠端骨轉移腫瘤信號在放療后消失,但在P-90MLXIPe-m6Ahigh中,脊柱兩側和骨盆均檢測到較強的信號(圖1G),提示MLXIPe-m6Ahigh患者存在放療耐藥。總而言之,MLXIPe的m6A修飾是骨mPCa所特異性的。
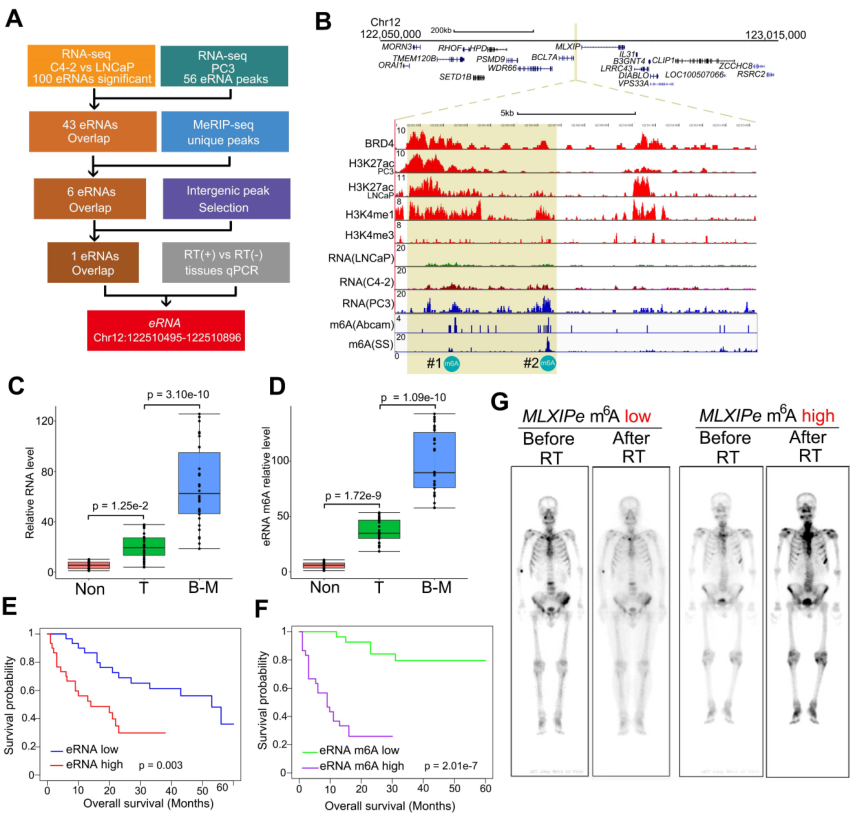
圖1 MLXIPe的m6A參與PC的轉移和化療
2、MLXIPe誘導的mPCa放療抵抗是通過上調PSMD9
eRNA通過增加增強子-啟動子環(huán)將增強子活性轉移到一個或幾個相鄰的目標啟動子上。為確定受MLXIPe增強子調控的下游啟動子,使用類似于染色體構象捕獲(3C)的策略研究了相鄰啟動子,并使用捕獲Hi-C(cHi-C)技術分析了已發(fā)表的數(shù)據(jù)。通過cHi-C的增強子-啟動子環(huán)確定了MLXIPe周圍的11個mRNA(圖2A)。通過RNA-seq數(shù)據(jù)排除PCa細胞中無表達的4個mRNA,通過3C檢測確定了人骨- mPCa患者來源的異種移植(PDX)原代細胞系90 (P-90)中7個啟動子的空間組織。3C數(shù)據(jù)顯示,利用反義寡脫氧核苷酸(ASOs)敲除MLXIPe會降低MLXIPe與WDR66、PSMD9、SETD1B和MLXIP位點之間的特異性增強子-啟動子相互作用(圖2A)。在通過基因組DNA相互作用鑒定出MLXIPe靶基因后,研究MLXIPe是否影響它們的轉錄。用ASOs敲除MLXIPe,驗證eRNA對靶蛋白表達的作用。利用3個獨立的ASOs進行逆轉錄qPCR和RNA-seq數(shù)據(jù)顯示,MLXIPe下調骨- mPCa原代細胞系P-90和PC3細胞中這4個靶基因的表達(圖2B-C)。還發(fā)現(xiàn)PSMD9是一個特異性的骨- mPCa相關基因,但WDR66、SETD1B和MLXIP是致癌基因(圖2D)。較高水平的PSMD9與較低的放療后無復發(fā)生存率相關(圖2E)。綜上所述,PSMD9作為MLXIPe骨特異性靶基因,與骨mPCa患者的放療耐藥和較短的生存期相關。
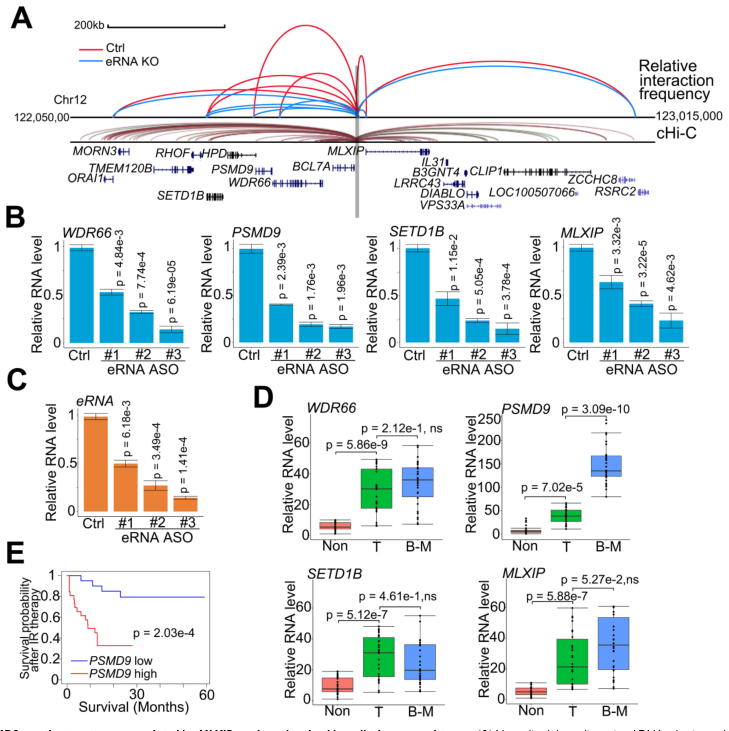
圖2 PSDM9是受到MLXIPe調控的靶基因并參與化療抵抗
3、MLXIPe通過m6A與KHSRP相互作用
通過生成 CRISPR 對照(Ctrl)和 MLXIPe #2-m6A 位點缺失(-del)細胞系,用生物素標記的探針靶向 MLXIPe eRNA 或 PSMD9 mRNA 進行無偏串聯(lián)親和純化,從而探索了m6A在MLXIPe的分子機制。質譜分析結果表明MLXIPe eRNA與多種蛋白質結合,包括對照(Ctrl)細胞中的循環(huán)蛋白 MED12和KH結構域蛋白hnRNPK、IGF2BP2或KHSRP,但在MLXIPe -m6A-del細胞中與KH結構域蛋白沒有結合(圖3A)。類似地,PSMD9 mRNA在Ctrl細胞中與幾種蛋白結合,包括翻譯蛋白eIF4A1、eIF4G2和KH結構域蛋白KHSRP,但在eRNA-m6A-del 細胞中不與KH結構域蛋白結合(圖3A)。KHSRP是一種與多種癌癥有關的RNA結合蛋白,是兩組引物中的共同蛋白(圖3B)。我們敲除了KHSRP蛋白的四個結構域(N-端、KH1/2、KH3/4或C-端缺失),以證實質譜數(shù)據(jù)(圖 3C)。交聯(lián)免疫沉淀(CLIP)-PCR檢測表明,KH1/2缺失結構域阻斷了KHSRP蛋白與PSMD9 mRNA的相互作用(圖3D),KH3/4缺失結構域顯著抑制了KHSRP與MLXIPe的相互作用(圖3E)。此后,作者進一步證明KHSRP是m6A和m6Am的雙解讀器,通過KH1/2結構域與m6Am相互作用,通過KH3/4結構域與m6A相互作用(圖4A)。

圖3 KHSRP與eRNA和mRNA結合形成一個復合物
4、KHSRP通過與eRNA連接來穩(wěn)定mRNA
鑒于m6A可調控mRNA的穩(wěn)定性,所以作者檢測了P-90細胞中RNA的半衰期,以確認m6Am與mRNA穩(wěn)定性的相關性。數(shù)據(jù)表明,2號m6A 缺失增加了PSMD9 mRNA降解,但在P-90和PC3胞中,1號-m6Am位點缺失未能完成降解(圖4B)。用兩個獨立的shRNA去掉KHSRP能顯著下調PSMD9 RNA水平并增強PSMD9 mRNA降解(圖4C-D)。據(jù)報道,m6Am的writer是PCIF1。PCIF1-KD損害了MLXIPe升高的PSMD9 RNA水平(圖4E)。XRN1和XRN2是高度過程性的5' > 3'外切核酸酶。基因敲除試驗表明,XRN2而不是XRN1是負責PSMD9 mRNA 降解的5' > 3' 外切核酸酶(圖4F)。敲除KHSRP會增加PSMD9 mRNA與XRN2的結合(圖4G)。此外,敲除XRN2會提高PSMD9 mRNA的穩(wěn)定性(圖4H)。這些數(shù)據(jù)表明,MLXIPe-KHSRP-PSMD9阻斷了骨 mPCa細胞中XRN2誘導的PSMD9 mRNA降解(圖4I)。
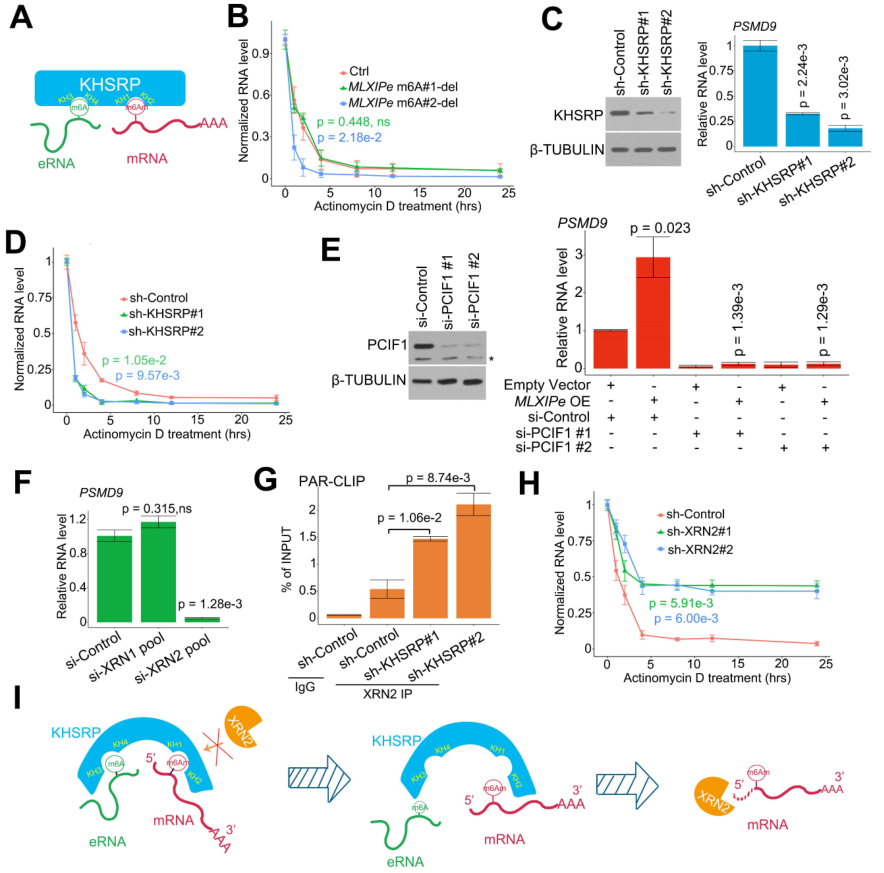
圖4 eRNA-KHSPR-mRNA復合物保護PSMD9 mRNA抵抗XRN2
5、MLXIPe通過m6A提高PCa細胞中DNA修復蛋白的水平
文獻表明PSMD9是與乳腺癌細胞放療抗性相關的放療預測標記物。本研究發(fā)現(xiàn),MLXIPe通過eRNA m6A介導PSMD9 mRNA的穩(wěn)定性并上調其蛋白水平(圖4)。作者從PDX隊列中選擇了4個MLXIPe m6Ahigh和MLXIP m6Alow的原發(fā)性骨-mPCa PDX細胞,以確定MLXIPe m6A是否是骨-mPCa中特異的放療耐藥性標志物。不同劑量輻射曲線數(shù)據(jù)表明,MLXIPe m6Ahigh的細胞對放療具有抗性;然而,MLXIPe m6Alow的細胞則以劑量依賴的方式被輻射殺死(圖5A)。WB顯示,在MLXIPe m6Ahigh細胞中,ATM、DNA-PKcs和p53蛋白水平上調,但ATR的表達不受影響(圖5B)。
作者敲除MLXIPe中的m6A,以進一步證實m6A在DNA修復途徑中的功能。表達數(shù)據(jù)顯示,MLXIPe WT而非MLXIPe-m6A缺失會提高ATM、DNA-PKcs和p53蛋白水平(圖5C)。在MLXIPe m6Alow的P-73細胞和MLXIPe m6Ahigh的P-90細胞中驗證了eRNA-KHSRP-mRNA復合物在DNA修復途徑中的功能。數(shù)據(jù)顯示,KHSRP的缺失抑制了MLXIPe對ATM、DNA-PKcs和p53蛋白的上調,并降低了MLXIPe m6Alow P-73細胞中γ-H2AX病灶的比例(圖5D)。同時,在MLXIPe m6A缺失的細胞中,XRN2敲除可挽救ATM、DNA-PKcs和p53蛋白水平,并提高γ-H2AX病灶的比率(圖5E)。這些數(shù)據(jù)表明,MLXIPe通過m6A和KHSRP復合物提高骨-mPCa細胞中的ATM、DNA-PKcs和p53蛋白水平。
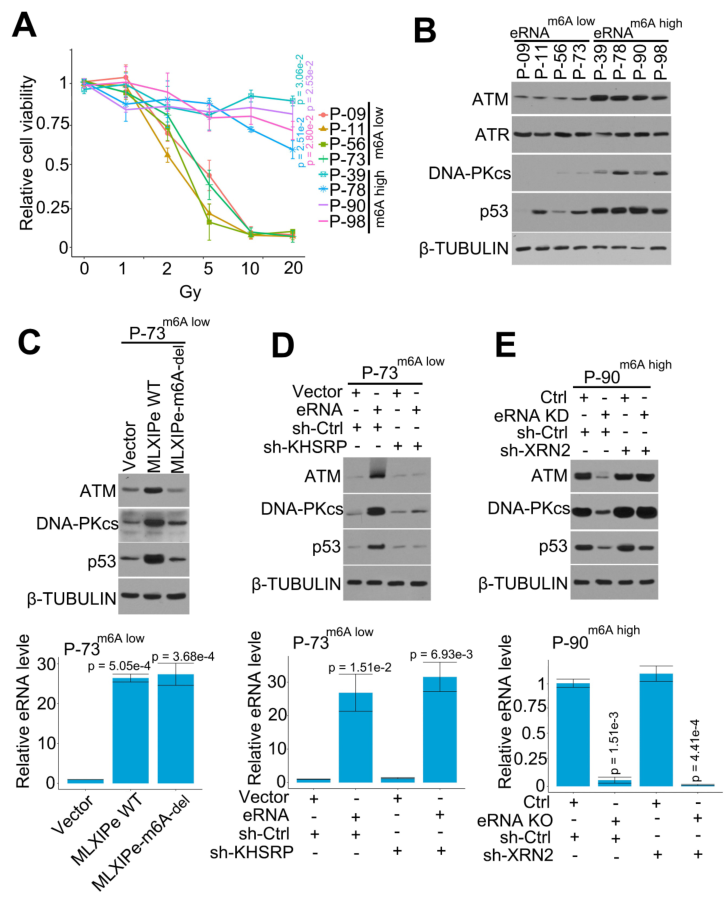
圖5 MLXIPe上調DNA修復通路的關鍵蛋白
6、MLXIPe通過m6A和KHSRP增強前列腺PDX放療耐藥性
通過編輯4個MLXIPe m6Ahigh PDX細胞中的m6A位點,測試MLXIPe的m6A在PDX細胞中的功能。數(shù)據(jù)顯示,在MLXIPe m6A位點缺失(-del)的mPCa細胞中,放療抗性受損,放射敏感性恢復(圖6A-B)。接下來,在體內異種移植模型中測定了MLXIPe的m6A功能,并考察了MLXIPe的m6A調控對前列腺異種移植生長和放射抗性的影響。將MLXIPe-m6A-del細胞注射到小鼠側腹,數(shù)據(jù)顯示MLXIPe-m6A敲除后,異種移植物的生長略有下降,而KHSRP-KD轉染則不影響異種移植物的生長(圖6C-D)。值得注意的是,MLXIPe-m6A-del組和KHSRP-KD組在放療36天后恢復放射敏感性,而Ctrl組沒有恢復(圖6D)。qPCR數(shù)據(jù)顯示,PSMD9 mRNA與異種移植物的放療抗性相關(圖6E-G)。因此,數(shù)據(jù)表明,MLXIPe或KHSRP的m6A可提高PDX模型中mPCa的放療耐受性。

圖6 在體內MLXIPe誘導化療抵抗
總之,本研究提供了有關mPCa RT抗性、eRNA修飾和潛在m6Am閱讀器機制的新見解。檢測到骨特異性eRNA與m6A,后者促進骨轉移前列腺PDXs的 放療抗性功能。KHSRP能識別eRNA上的m6A和mRNA 5'-UTR上的m6Am并與之相互作用,從而阻斷XRN2對5'-UTR上RNA的降解。研究結果表明,骨特異性eRNA-m6 在 mPCa生長和放療抗性方面至關重要,可能成為癌癥治療的新靶點(圖6)。我們的研究強調了MLXIPe是骨-mPCa的潛在預測性生物標記物和治療靶點。
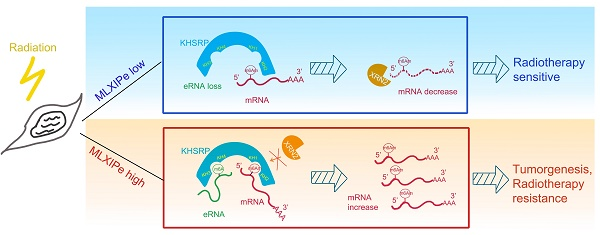
圖像摘要
實驗方法
臨床樣本收集,患者來源的異種移植(PDX),正電子發(fā)射斷層掃描(PET),小鼠異種移植瘤模型,生物素標記的RNA pull down,WB,CRISPR)-Cas9,交聯(lián)免疫沉淀(CLIP),γ-H2AX染色
參考文獻
Zhao Y, Wen S, Li H, Pan CW, Wei Y, Huang T, Li Z, Yang Y, Fan S, Zhang Y. Enhancer RNA promotes resistance to radiotherapy in bone-metastatic prostate cancer by m6A modification. Theranostics. 2023 Jan 1;13(2):596-610. doi: 10.7150/thno.78687. PMID: 36632223; PMCID: PMC9830431.






