CD73抑制cGAS-STING并與CD39協同促進胰腺癌
實驗方法:MetaGx胰腺基因表達數據集采集,基因簽名,定量免疫熒光分析,ELISAs,Western blots,CD39 IHC分析,TILs的FACS分析,實時定量PCR,球體形成和OT-I活化試驗,體外增殖試驗,g-H2AX免疫熒光
外核苷酶CD39和CD73催化細胞外ATP產生免疫抑制腺苷,代表了潛在的癌癥靶點。我們通過臨床樣本和實驗小鼠腫瘤研究CD39和CD73在胰腺導管腺癌(PDAC)中的生物學影響。在人類PDAC樣本中,基質CD39和腫瘤CD73的表達與較差的生存率顯著相關,并消除了與腫瘤浸潤CD8+ T細胞存在相關的有利預后影響。在小鼠移植的KPC腫瘤中,骨髓細胞上的CD39和CD73以及腫瘤細胞上的CD73均可促進浸潤性骨髓細胞向M2樣表型極化,從而促進腫瘤生長。腫瘤特異性CD8+ T細胞和胰腺星狀細胞上的CD39也抑制T細胞產生IFNg。雖然治療性抑制CD39或CD73在體內顯著延緩腫瘤生長,但靶向這兩種外核苷酶顯示出明顯更好的抗腫瘤活性。CD73在人和小鼠PDAC腫瘤細胞上的表達也對吉西他濱和輻照誘導的DNA損傷具有保護作用。人類PDAC細胞系的大規模藥物基因組學分析揭示了CD73表達與吉西他濱化療耐藥之間的顯著關聯。CD73缺陷腫瘤細胞中DNA損傷的增加與cGAS-STING通路的激活有關。CD73抑制劑AB680的體內抗腫瘤活性需要cGAS在小鼠KPC腫瘤細胞中的表達。我們的研究闡明了CD73和CD39似乎合作促進PDAC進展的分子機制。
技術路線:

結果:
(1) 腫瘤CD73和間質CD39都與PDAC的低生存率相關
為研究PDAC中腺苷通路對預后的影響,我們在12項獨立研究中對1200多名PDAC患者進行了CD73和CD39的基因表達薈萃分析。CD73與較差的OS顯著相關(圖1A)。CD39總體上與較好的OS相關,盡管這在單個隊列中沒有達到統計學意義(補充圖未展示)。我們在兩個最大的隊列中探討了CD73和CD39之間的預后關聯。只有當PDAC腫瘤同時具有高CD39表達時,才觀察到CD73與較差預后的關聯(圖1B)。兩個最大隊列的相關分析進一步揭示了CD39基因表達與細胞毒性T細胞、Tregs和T細胞衰竭標志物(即PDCD1、CTLA4、TIGIT、LAG3)之間的顯著正相關,而CD73則沒有顯著相關性(圖1C)。
我們研究了來自獨立隊列的PDAC手術樣本的上皮和間質中CD73(圖2A)和CD39(圖2B)蛋白表達的組織學分布。與匹配的正常鄰近胰腺組織相比,CD73在PDAC腫瘤上皮中顯著上調,而在腫瘤間質中表達微弱但顯著下調(圖2C)。CD39在PDAC腫瘤間質中顯著上調(圖2D)。腫瘤上皮CD73與高分期和低分化PDAC腫瘤之間存在顯著關聯。而CD39與臨床病理特征之間無相關性。
生存分析顯示,更高的腫瘤上皮CD73表達(圖2E)和更高的腫瘤間質CD39表達(圖2F)與PDAC患者更差的OS相關。在多變量分析中,當調整術前CA 19-9、淋巴結狀態、分化和切除邊緣時,腫瘤上皮CD73表達與較差的OS相關。結合上皮CD73和間質CD39表達的生存分析提供了進一步的預后(補充圖未展示)。
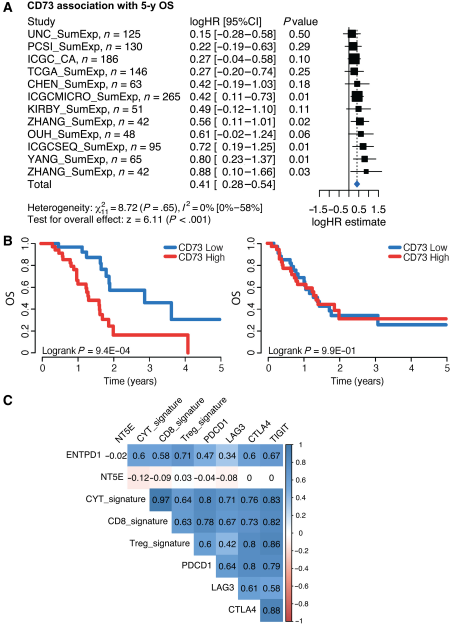
圖1:CD73基因表達與PDAC預后不良相關
(2) CD73和CD39消除了腫瘤浸潤性CD8+ T細胞的良好預后影響
正如在其他PDAC隊列中所顯示的那樣,腫瘤浸潤性CD8+ T細胞的存在與OS改善相關(補充圖未展示)。支持我們的基因表達數據(圖1C),CD39蛋白表達與CD8+ T細胞浸潤呈正相關,而CD73蛋白表達與腫瘤浸潤的CD8+ T細胞不相關(補充圖未展示)。我們研究了CD73或CD39表達是否影響PDAC免疫監測。腫瘤上皮CD73(圖2G)或腫瘤間質CD39(圖2H)的高表達完全取消了腫瘤浸潤性CD8+ T細胞在PDAC患者中的良好預后價值。
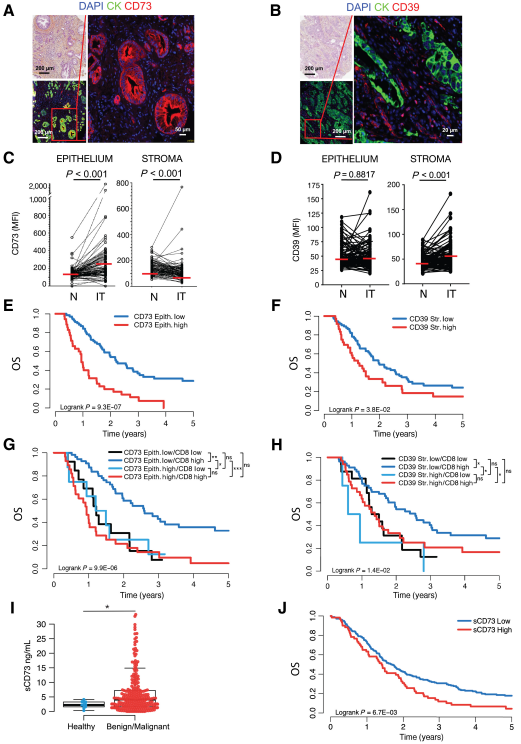
圖2:腫瘤CD73和間質CD39蛋白表達與PDAC預后不良和免疫監視抑制相關
(3) 可溶性CD73與更差的PDAC生存相關
由于CD73可以從細胞表面切割并以可溶性形式存在,我們評估了可溶性CD73 (sCD73)是否可以作為PDAC的無創預后生物標志物。在一項獨立隊列研究中,良性或惡性胰腺腫瘤患者的sCD73水平明顯高于健康供體(圖2I)。PDAC患者較高的sCD73與較高的CA 19-9水平、位于胰腺頭部的腫瘤、較高的分期和淋巴血管侵犯相關(補充表未展示)。較高的sCD73也與較差的OS顯著相關(圖2J)。然而,在多變量分析中,sCD73沒有達到顯著性。我們評估了血清中sCD73是否可以作為PDAC腫瘤中CD73表達的替代指標。在亞隊列中,未觀察到可溶性和腫瘤CD73水平之間的相關性。
(4) 腫瘤細胞和髓樣細胞上的CD73有利于小鼠PDAC中M2樣髓樣細胞的浸潤
我們利用Crispr/Cas9介導的基因缺失研究了腫瘤來源的CD73在小鼠KPC或人PANC1腫瘤細胞系中的作用。KPC和PANC1表達CD39為陰性(補充圖未展示)。在體外,腫瘤來源的CD73對腫瘤細胞增殖無影響(補充圖未展示)。腫瘤源性CD73的缺失顯著降低了KPC腫瘤在體內的生長,并改善了吉西他濱活性(圖3A)。這與腫瘤IFNg水平的顯著增加以及IL10和精氨酸酶-1的微弱但顯著的增加相關(圖3B)。腫瘤源性CD73的缺失還顯著降低了KPC腫瘤中M2樣腫瘤相關巨噬細胞(TAM)和單核髓源性抑制細胞(M-MDSC)的浸潤和極化(圖3C)。靶向腫瘤來源的CD73對CD8、CD4或粒細胞(G)-MDSC浸潤沒有影響。由于CD73在KPC浸潤的髓細胞上表達,我們評估了髓源性CD73的作用。條件CD73fl/fl小鼠與LysMCre+/?小鼠(骨髓特異性CD73缺失),并用CD73陰性的KPC腫瘤細胞攻擊。髓源性CD73顯著促進KPC腫瘤生長(圖3D),促進M2樣TAMs的浸潤(圖3E)和M2極化。骨髓來源的CD73對腫瘤浸潤性CD8、CD4、M-MDSCs或G-MDSCs沒有影響(補充圖未展示)。
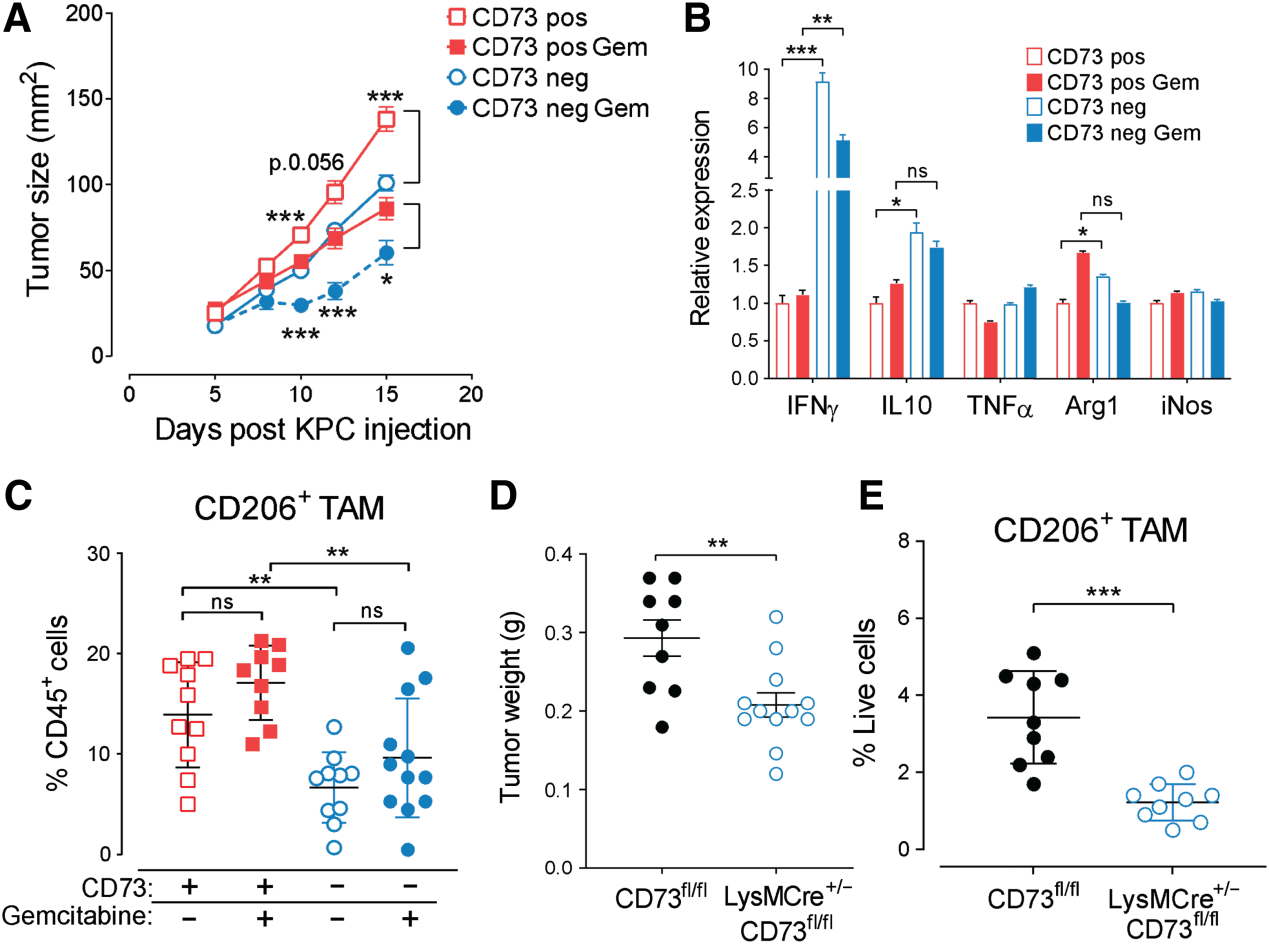
圖3:腫瘤細胞和骨髓細胞上的CD73促進小鼠PDAC
(5) 骨髓細胞、成纖維細胞和T細胞上的CD39抑制抗PDAC免疫反應
我們研究了CD39的作用。由于髓系細胞是KPC腫瘤中CD39的主要來源,我們評估了在條狀CD39fl/fl LysMCre+/?用KPC腫瘤細胞攻擊小鼠。髓系細胞CD39缺失顯著降低KPC腫瘤生長(圖4A)和顯著減少M2樣TAM浸潤(圖4B)。與我們在CD73中觀察到的情況相反,骨髓特異性缺失CD39還與腫瘤浸潤性CD8+ T細胞和CD4+Foxp3? T細胞(圖4C)。
我們評估了CD39在腫瘤相關成纖維細胞和效應CD8+ T細胞中的作用。我們使用體外球體培養物來測量T細胞的功能,球體培養物由表達OVA的KPC腫瘤細胞、原代胰腺星狀細胞(WT或CD39?/?)和OVA特異性CD8+ OT-I細胞(WT或CD39?/?;圖4D)。CD39?/? OT-I CD8+ T細胞,以及CD39?/?胰腺星狀成纖維細胞,每一種都顯著增加了OT-I效應T細胞產生的IFNγ (圖4D)。
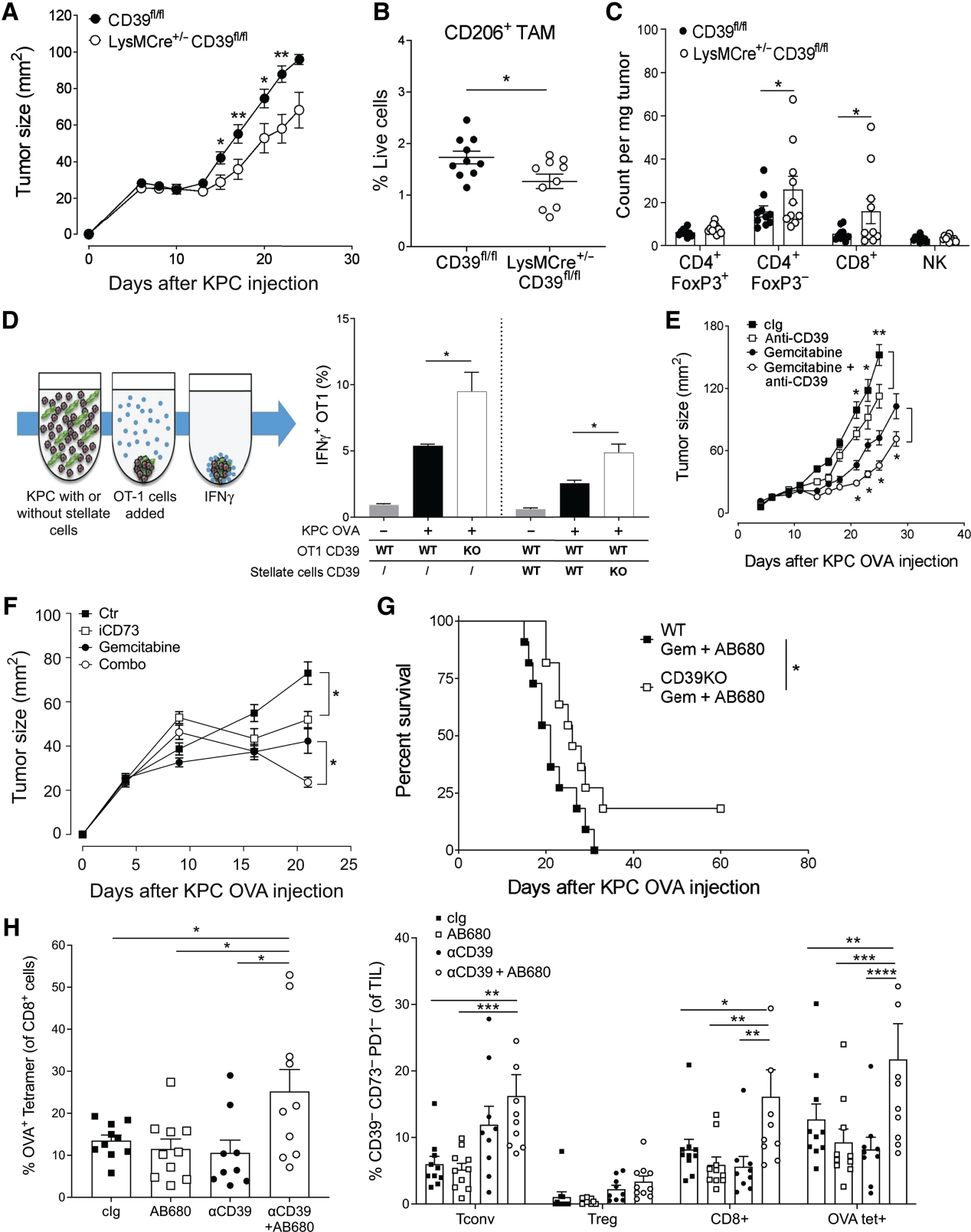
圖4:CD39與CD73協同促進小鼠PDAC
(6) 靶向CD39和CD73增強吉西他濱抗小鼠PDAC的活性
我們評估了CD39是否代表針對PDAC的治療靶點。從第7天開始,用阻斷性單克隆抗小鼠CD39治療已建立的KPC腫瘤(>25 mm2),每周3次,單獨或聯合吉西他濱(100 mg/kg,第7天和第10天)。抗CD39單藥治療顯著延緩了KPC腫瘤的生長,并顯著增強了吉西他濱對已建立腫瘤的活性(圖4E)。同樣,使用選擇性CD73抑制劑(即AB680)治療也顯著抑制了KPC腫瘤的生長,增強了吉西他濱的活性(圖4F)。
我們評估CD39和CD73是否具有冗余的致瘤作用。將KPC腫瘤注射到WT和CD39?/?用CD73抑制劑AB680聯合吉西他濱治療。與吉西他濱聯合靶向宿主來源的CD39進一步增強了CD73抑制的治療活性(圖4G)。使用不同的KPC模型(即KPC 1199細胞)。用AB680、單克隆抗CD39或兩者同時治療的KPC-OVA腫瘤的免疫分析顯示,只有聯合抑制CD73和CD39才能顯著增加腫瘤特異性T細胞浸潤,并阻止PD-1衰竭標志物的獲得(圖4H)。我們的結果揭示了CD73和CD39在促進PDAC中的非冗余作用。
(7) 腫瘤來源的CD73保護DNA損傷并抑制cGAS-STING
由于PDAC細胞表達高CD73,但不表達CD39,我們研究了CD73是否以細胞自主的方式賦予PDAC腫瘤細胞增殖優勢。CD73基因沉默在正常培養條件下對小鼠或人PDAC細胞的存活和增殖沒有影響。然而,在KPC或PANC1細胞中,CD73缺失顯著增強了腫瘤細胞對吉西他濱的體外敏感性(圖5A, B)。為了進一步評估CD73在PDAC化療耐藥中的作用,我們在三個最大的藥物基因組學藥物篩選研究中確定CD73基因表達是否與吉西他濱敏感性相關。PDAC細胞系中CD73基因表達與吉西他濱反應呈顯著負相關(C-index=0.62, P<0.001;圖5C),由藥物劑量-反應曲線上方的面積測量。與之一致的是,gH2AX染色顯示,吉西他濱治療CD73缺陷的KPC腫瘤細胞誘導了更大的DNA損傷(圖5D, E)。CD73表達的部分恢復恢復了表型并減少了DNA損傷(補充圖未展示)。在輻照反應(圖5F)和用CD73抑制劑AB680處理的人PANC1腫瘤細胞(圖5G)中獲得了類似的結果。用選擇性激動劑(BAY 60-6583)激活A2B受體恢復了這種表型,正如吉西他濱處理的PANC1在A2B受體激活(圖5G)和PKC細胞(圖5H)后DNA損傷顯著減少所揭示的那樣。
DNA傳感器cGAS可以通過產生cGAMP將DNA損傷與炎癥聯系起來,cGAMP反過來激活STING依賴基因轉錄。由于CD73表達可以保護PDAC細胞免受DNA損傷,我們研究了CD73是否可以抑制cGAS-STING的激活。與吉西他濱治療后CD73缺失的腫瘤細胞相比,CD73缺失的KPC細胞產生了顯著更高的cGAMP(圖5I),表達了顯著更高的STING靶基因(圖5J)。這提示cGAS-STING通路可能在CD73抑制的治療活性中起作用。為了驗證這一點,我們通過Crispr/Cas9從親本KPC細胞中刪除了cGAS,生成了一個由確認cGAS-STING激活缺失的單個克隆組成的多克隆群體,并評估了AB680對cGAS缺失的KPC腫瘤和控制表達Cas9的KPC腫瘤的治療活性。腫瘤細胞中cGAS的缺失消除了AB680的體內活性(圖5K)。使用基于shRNA的cGAS敲除也獲得了類似的結果(補充圖未展示)。我們的數據突出了CD73在調節cGAS-STING通路中的作用,并強調了腫瘤cGAS激活對CD73抑制劑治療活性的重要性。

圖5:CD73促進DNA損傷修復并抑制cGAS-STING激活
結論:我們的研究支持進一步評估CD39和CD73在PDAC中的生物學作用,作為免疫檢查點和對吉西他濱產生化學耐藥。我們證明CD39和CD73都與不良的臨床結果顯著相關,并抑制腫瘤對PDAC的免疫監視。我們建議靶向CD39-CD73軸將有利于免疫冷腫瘤,如PDAC。
參考文獻:Jacoberger-Foissac, C., Cousineau, I., Bareche, Y., Allard, D., Chrobak, P., Allard, B., Pommey, S., Messaoudi, N., McNicoll, Y., Soucy, G., Koseoglu, S., Masia, R., Lake, A. C., Seo, H., Eeles, C. B., Rohatgi, N., Robson, S. C., Turcotte, S., Haibe-Kains, B., & Stagg, J. (2023). CD73 Inhibits cGAS-STING and Cooperates with CD39 to Promote Pancreatic Cancer. Cancer immunology research, 11(1), 56–71. https://doi.org/10.1158/2326-6066.CIR-22-0260.






