PP4抑制通過STAT1激活和炎癥信號增強卵巢癌對NK細(xì)胞介導(dǎo)的細(xì)胞毒作用的敏感性
T細(xì)胞在卵巢腫瘤中的浸潤增加已被反復(fù)證明可以預(yù)測患者生存率的提高。然而,盡管有證據(jù)表明卵巢癌(ovarian cancer,OC)中存在主動免疫反應(yīng),但OC對免疫檢查點阻斷(ICB)治療的反應(yīng)頻率遠(yuǎn)低于其他癌癥類型。最近的研究強調(diào),DNA損傷反應(yīng)(DDR)的缺陷會導(dǎo)致基因組不穩(wěn)定性和腫瘤免疫原性的增加,從而導(dǎo)致對ICB的反應(yīng)增強。蛋白磷酸酶4(PP4)是DDR的關(guān)鍵調(diào)節(jié)因子。然而,其在抗腫瘤免疫中的潛在作用目前尚不清楚。本研究明確抑制PP4在促進炎癥信號傳導(dǎo)和增強免疫
細(xì)胞效應(yīng)功能中的作用。這些發(fā)現(xiàn)為進一步研究PP4抑制劑增強OC的化學(xué)免疫治療提供了支持。本研究于2022年12月發(fā)表于期刊《J Immunother Cancer》上,IF:12.469。
技術(shù)路線:

主要研究結(jié)果:
為更好的研究理解PP4在敖正中的作用,作者利用TCGA數(shù)據(jù)庫研究PPP4C, PPP4R3A, PPP4R3B, PPP4R2亞基的基因組水平變化,發(fā)現(xiàn)PP4亞基基因在大約6%的OC腫瘤中主要擴增(圖1A)。類似于OC,浸潤性乳腺癌,膀胱尿路上皮癌和景園細(xì)胞劉也顯示PP4亞單位基因顯著擴增(圖1A)。此外,還觀察到信使之間有顯著的一致性和泛癌TCGA數(shù)據(jù)庫中PPP4C的RNA水平(圖1B)。為評估在OC中靶向PP4復(fù)合物的效用,作者接下來評估OC TCGA數(shù)據(jù)集中PP4亞基的表達水平。利用RNA-seq數(shù)據(jù),發(fā)現(xiàn)與正常卵巢和輸卵管組織相比,PPP4C在OC中顯著過表達(圖1C),而調(diào)節(jié)亞基的表達水平是可變的。PPP4R3B和PPP4R2 mRNA表達增加。相比之下,PPP4R3A在正常組織中含量更高(圖1C)。在蛋白質(zhì)水平上,PP4C被發(fā)現(xiàn)在代表性的高級別漿液性卵巢癌(HGSOC)細(xì)胞系中穩(wěn)定表達(圖1D)。作者注意到PPP4R3β調(diào)節(jié)亞基在OC細(xì)胞系中的表達變化,其中HTYK-nu和59M的表達變化最小(圖1D)。類似的結(jié)論在PPP4R3α和PPP4R2中也可以觀察到(圖1D)。總之,上述數(shù)據(jù)表明PP4C在OC中表阿達上調(diào)。
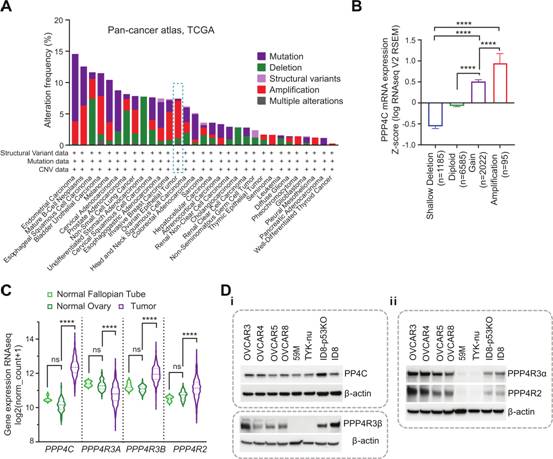
圖1 PP4亞基在卵巢癌中擴增
作者使用CRISPR生成p53敲除ID8細(xì)胞系模型。在ID8-p53WT和ID8-p53KO中,用siRNA敲低PPP4C表明,PP4C表達的缺失導(dǎo)致這兩種細(xì)胞系對卡鉑的敏感性增加(圖2A)。WB證實轉(zhuǎn)染siRNA后PP4C的表達(圖2A)。作者通過正交試驗獲得了PP4C穩(wěn)定敲除的ID8-p53 KO細(xì)胞。與siRNA結(jié)果一致,與載體對照或親代細(xì)胞相比,低PP4C表達的ID8-p53KO細(xì)胞對卡鉑處理越來越敏感(圖2B)。WB證實抗生素選擇后PP4C的表達(圖2B)。同樣,在ID8小鼠細(xì)胞系中,以納摩爾水平使用PP4的藥理抑制劑fostriecin治療也導(dǎo)致對卡鉑的敏感性增強(圖2C)。與卡鉑單獨處理相比,fostriecin和卡鉑聯(lián)合處理ID8-p53KO和人OC細(xì)胞系OVCAR3和OVCAR8的集結(jié)腸形成能力下降(圖2D-E)。這些發(fā)現(xiàn)表明抑制PP4活性可導(dǎo)致OC卡鉑敏感性增加。細(xì)胞熱位移實驗(CETSA)表明fostriecin處理提高PP4C蛋白的熱穩(wěn)定性,這證實PP4C是fostriecin在OC細(xì)胞系中的直接靶點(圖2F)。
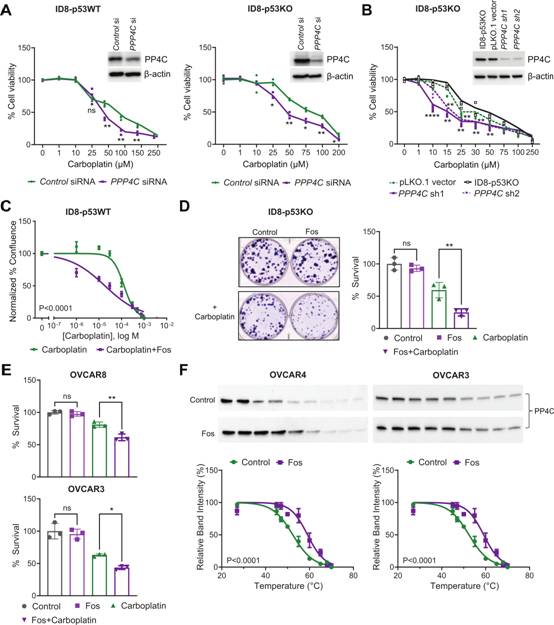
圖2 PP4抑制或敲除使卵巢癌細(xì)胞系對卡鉑敏感
3、抑制PP4C可增強卡鉑誘導(dǎo)的DNA損傷
作者發(fā)現(xiàn),fostriecin聯(lián)合卡鉑抑制PP4導(dǎo)致多個OC細(xì)胞系微核形成增加(圖3A)。作者試圖確定fostriecin處理是否影響H2AX(S139)磷酸化(γ-H2AX),結(jié)果表明,fostriecin與卡鉑聯(lián)合治療可增加γ-H2AX病灶的數(shù)量(圖3B),γ-H2AX焦點強度,以及OC細(xì)胞整體γ-H2AX水平。由于已知卡鉑可以誘導(dǎo)鏈間交聯(lián)(interstrand crosslinks,ICLs),作者接下來研究是否FANCD2焦點,ICLs的關(guān)鍵傳感器,被PP4抑制改變。與文獻報道一致,作者發(fā)現(xiàn)卡鉑治療后FANCD2焦點增加。然而,fostriecin處理并沒有增加每個細(xì)胞中FANCD2焦點的數(shù)量(圖3B)。用RAD51抑制劑處理的細(xì)胞,B-02,作為陽性對照。通過siRNA或fostriecin處理PPP4C可以抑制DR-GFP細(xì)胞系的HR(圖3C)。這些數(shù)據(jù)表明,抑制PP4導(dǎo)致增加卡鉑治療后OC細(xì)胞系DNA損傷和基因組不穩(wěn)定性標(biāo)記。
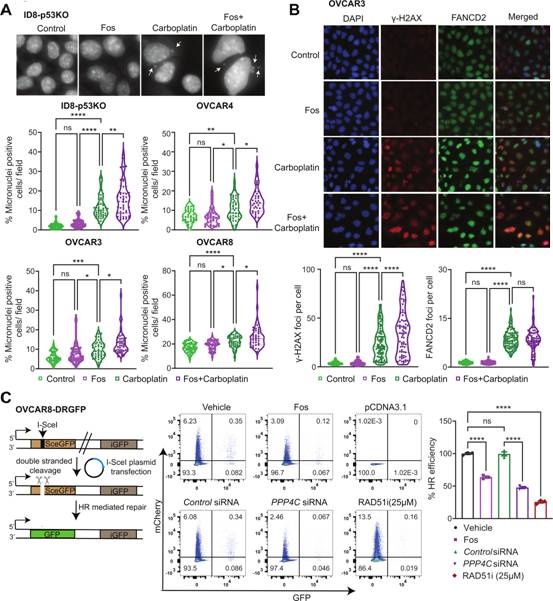
圖3 PP4的藥理抑制增強卡鉑誘導(dǎo)的DNA損傷
4、PP4抑制促進OC炎癥信號通路
由于抑制PP4后觀察到的微核增加(圖3A),作者推測在PP4活性喪失的情況下,OC細(xì)胞中炎癥信號會增加。STAT1的完全轉(zhuǎn)錄激活需要額外的S727磷酸化。作者發(fā)現(xiàn),與卡鉑單獨處理相比,fostriecin和卡鉑聯(lián)合處理導(dǎo)致OC細(xì)胞系中STAT1(Y701)磷酸化增加(圖4A)。與fostriecin治療相似,PPP4C聯(lián)合卡鉑也導(dǎo)致OC細(xì)胞系中STAT1激活增加(圖4B)。作者在OVCAR3和OVCAR8細(xì)胞中觀察到磷酸化p65在福司曲星和卡鉑作用下顯著上調(diào)(圖4C)。siRNA聯(lián)合卡鉑處理敲低PPP4C表達后,經(jīng)典的NF-kB(p65)也被激活(圖4D)。在mRNA水平,發(fā)現(xiàn)卡鉑與fostriecin或PPP4C siRNA聯(lián)合處理后,IFNB1、CCL5、CXCL10和IL - 6增加(圖4E)。而且,作者還觀察到PP4C敲低后,額外的衰老相關(guān)分泌表型(SASP)相關(guān)細(xì)胞因子IL - 8、CCL2、TNF - α和CXCL9表達增加(圖4F)。總之,這些數(shù)據(jù)表明抑制PP4增強卡鉑誘導(dǎo)的OC細(xì)胞系中的炎癥信號。
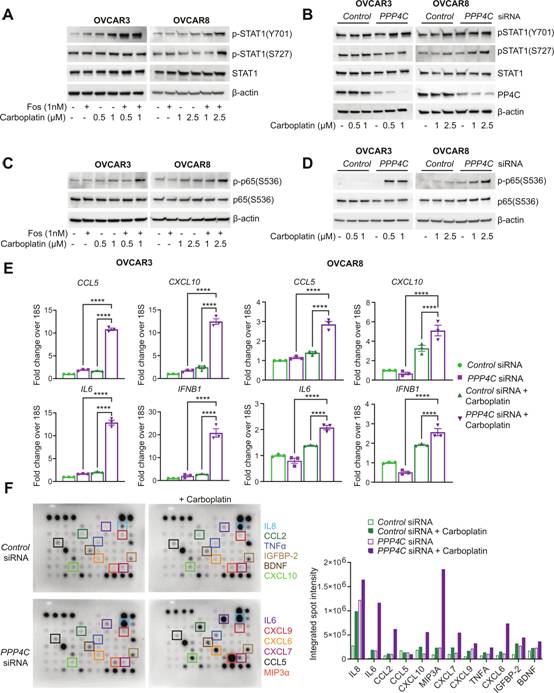
圖4 PP4活性的缺失增強了DNA損傷誘導(dǎo)的炎癥信號
5、PP4在OC細(xì)胞中的抑制促進了通過STING途徑的免疫細(xì)胞遷移
將小鼠OT - I CD8 T細(xì)胞或NK - 92細(xì)胞分別置于含有小鼠或人OC條件培養(yǎng)基的Boyden小室中(圖5A)。當(dāng)小鼠CD8 T細(xì)胞和NK - 92細(xì)胞暴露于fostriecin和卡鉑聯(lián)合處理的OC細(xì)胞的條件培養(yǎng)基時,表現(xiàn)出增強的遷移能力(圖5A)。與文獻報道的Rac信號在趨化因子誘導(dǎo)的細(xì)胞遷移中的作用一致,作者觀察到在Rac抑制劑存在的情況下,CD8 T和NK細(xì)胞的遷移顯著減少(圖5B)。然而,作者觀察到MEK和STAT3抑制劑的細(xì)胞類型特異性反應(yīng)。STAT3抑制劑Stattic抑制CD8 T細(xì)胞遷移,但增加NK - 92細(xì)胞遷移(圖5B)。與STAT3信號類似,MEK抑制也導(dǎo)致CD8 T和NK細(xì)胞的不同細(xì)胞反應(yīng)。有趣的是,MEK抑制劑抑制NK細(xì)胞遷移,而CD8 T細(xì)胞遷移不受影響(圖5B)。為確定c GAS - STING信號是否在觀察到的T和NK細(xì)胞遷移增加中發(fā)揮作用,作者通過實驗發(fā)現(xiàn)STING1敲低的OVCAR8細(xì)胞條件培養(yǎng)基抑制PP4后不能刺激人CD8 T細(xì)胞遷移(圖5C)。這些數(shù)據(jù)表明,在OC細(xì)胞中,PP4抑制刺激的促炎信號是通過STING激活介導(dǎo)的。
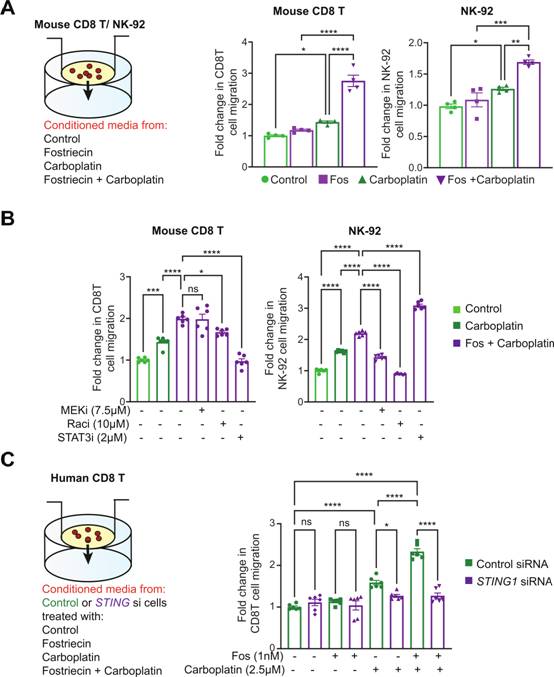
圖5蛋白磷酸酶4在卵巢癌細(xì)胞中的下調(diào)增強了效應(yīng)免疫細(xì)胞的遷移
6、在腫瘤細(xì)胞中敲低PP4C增強NK細(xì)胞的活化和對OC的細(xì)胞毒性
作者發(fā)現(xiàn),與對照組相比,PPP4C或PPP4R3B敲低后IFN - γ + NK細(xì)胞顯著增加,而卡鉑進一步增加了IFN - γ + NK細(xì)胞(圖6A-B)。作者接下來評估NK - 92細(xì)胞與轉(zhuǎn)染對照、PPP4C或PPP4R3B siRNA的OVCAR8細(xì)胞共培養(yǎng)3小時后NK細(xì)胞脫顆粒情況,發(fā)現(xiàn)CD107a + NK - 92細(xì)胞對PPP4C或PPP4R3B的敲低反應(yīng)顯著增加。作者還觀察到與卡鉑處理的細(xì)胞共培養(yǎng)時CD107a + NK - 92細(xì)胞群顯著增加(圖6C)。為進一步確定PP4缺失介導(dǎo)的NK細(xì)胞活化和脫顆粒的增加是否有助于NK細(xì)胞介導(dǎo)的OC細(xì)胞殺傷的增加,作者將轉(zhuǎn)染對照、PPP4C或PPP4R3B siRNA的OC細(xì)胞系與NK - 92細(xì)胞共培養(yǎng)。作者的結(jié)果表明,在OC中PPP4C或PPP4R3B的表達缺失增強NK細(xì)胞介導(dǎo)的OC細(xì)胞殺傷(圖6D)。卡鉑處理導(dǎo)致OVCAR8細(xì)胞的殺傷顯著增加,在PP4C和PPP4R3β敲低的細(xì)胞中進一步增加(圖6D)。因此,PP4的缺失促進NK細(xì)胞活化和NK細(xì)胞定向的卵巢癌殺傷。
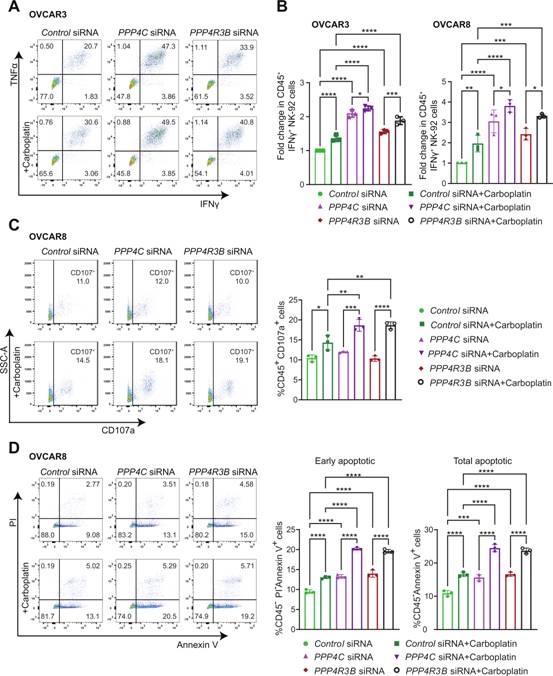
圖6PP4的缺失促進NK細(xì)胞活化和NK細(xì)胞定向的卵巢癌殺傷
7、在一個同基因的、具有免疫功能的OC小鼠模型中,敲低PP4C會導(dǎo)致腫瘤生長減少和效應(yīng)免疫細(xì)胞浸潤增加
接下來,作者試圖評估PP4C敲低對OC腫瘤生長的影響。研究構(gòu)建了PP4C表達降低的ID8 - p53KO細(xì)胞(圖2B)。在體內(nèi),PP4C敲低導(dǎo)致整體腫瘤生長顯著降低(圖7A-B)。此外,與對照組相比,PP4C敲低的腫瘤中腹水形成顯著減少(圖7C)。接下來,作者測定了腫瘤、脾臟、腹腔淋巴結(jié)和腹水中的細(xì)胞變化,觀察到,與對照組相比,PP4C shRNA腫瘤中NK細(xì)胞( CD3-CD161 + )和NK T細(xì)胞( CD3 + CD161 + )浸潤均顯著增加(圖7D-I),而卡鉑治療后沒有額外增加(圖7D-E)。與浸潤增加一致,作者在PP4C shRNA腫瘤中也發(fā)現(xiàn)IFN - γ+ NK細(xì)胞( CD3-CD161 + )增加(圖7F)。此外,作者觀察到PP4C shRNA腫瘤內(nèi)CD4 + T細(xì)胞數(shù)量顯著增加,且不受卡鉑處理的影響(圖7G)。有趣的是,在PP4C shRNA腫瘤中,卡鉑治療顯著增加了腫瘤內(nèi)CD8 + T細(xì)胞的數(shù)量,而在對照組中沒有觀察到(圖7H)。此外,作者發(fā)現(xiàn)作為調(diào)節(jié)性T細(xì)胞代表的CD4 + CD25 + T細(xì)胞群在所有組別中保持不變(圖7I)。這些數(shù)據(jù)表明抑制PP4C降低腫瘤負(fù)擔(dān),增強免疫效應(yīng)細(xì)胞腫瘤浸潤。
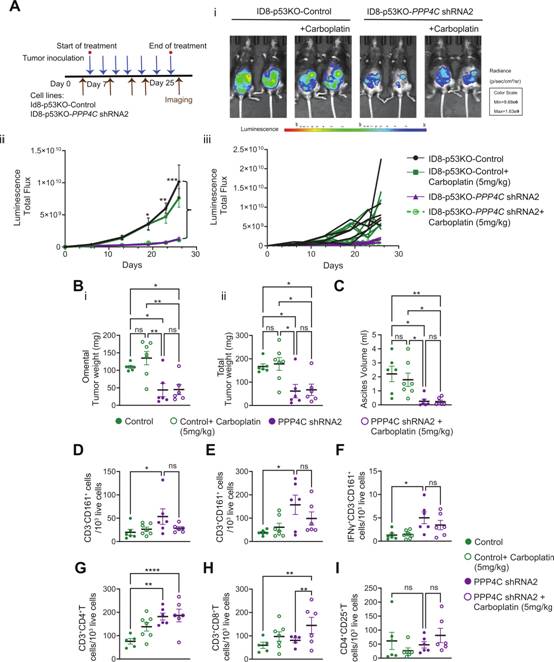
圖7抑制PP4C增強免疫細(xì)胞浸潤
結(jié)論:
綜上所述,本研究突出了PP4在抗腫瘤免疫中的作用以及需要特異性抑制劑進行有效的臨床轉(zhuǎn)譯。據(jù)作者所知,這是第一份證明在癌細(xì)胞中敲除或抑制PP4會增強免疫效應(yīng)細(xì)胞的遷移、功能和腫瘤浸潤的報告。根據(jù)這些發(fā)現(xiàn),作者認(rèn)為PP4是OC中一個有吸引力的治療靶點,值得進一步研究。
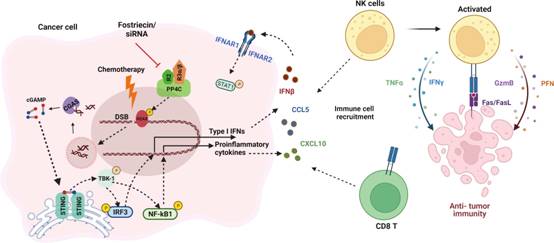
圖8 PP4C參與抗免疫抑制的機制圖
參考文獻:
Raja R, Wu C, Bassoy EY, Rubino TE Jr, Utagawa EC, Magtibay PM, Butler KA, Curtis M. (2022) PP4 inhibition sensitizes ovarian cancer to NK cell-mediated cytotoxicity via STAT1 activation and inflammatory signaling. J Immunother Cancer. 10(12):e005026. doi: 10.1136/jitc-2022-005026. PMID: 36564125






