晝夜節(jié)律基因NFIL3的高表達(dá)通過(guò)抑制NFKBIA轉(zhuǎn)錄而激活NF-κB信號(hào)通路,從而促進(jìn)TNBC的進(jìn)展
流行病學(xué)研究證實(shí),晝夜節(jié)律異常與乳腺癌的發(fā)生有關(guān)。然而,很少有研究探討節(jié)律基因在乳腺癌進(jìn)展中的病理作用。目前,有研究發(fā)現(xiàn)節(jié)律基因NFIL3在體外和體內(nèi)均能促進(jìn)乳腺癌細(xì)胞的增殖和轉(zhuǎn)移,該研究發(fā)表在《JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH》,IF:11.161。
技術(shù)路線:

主要研究結(jié)果:
1. NFIL3 mRNA的減少表明,通過(guò)篩查乳腺癌節(jié)律基因的異常表達(dá),TNBC中NFIL3蛋白升高
作者從基于TCGA數(shù)據(jù)集和GTEx數(shù)據(jù)集,搜索GEPIA數(shù)據(jù)庫(kù),研究了32個(gè)節(jié)律基因在乳腺癌中的異常表達(dá),其中與正常乳腺組織相比,乳腺癌組織中CRY2、NFIL3、PER1、EGR3、NR1D1和TIMELESS 6個(gè)節(jié)律基因的表達(dá)發(fā)生了顯著變化(圖1A)。q-PCR結(jié)果驗(yàn)證了這6個(gè)節(jié)律基因在臨床樣本的mRNA水平,證實(shí)了NFIL3和EGR3在乳腺癌中的異常表達(dá)與GEPIA數(shù)據(jù)庫(kù)的結(jié)果一致(圖1B)。EGR3 mRNA在HER2陽(yáng)性乳腺癌亞型中顯著下調(diào),而NFIL3 mRNA在TNBC亞型中特異性低于其他亞型乳腺癌(圖1C)。因此,作者選擇NFIL3做后續(xù)研究。免疫組化評(píng)估NFIL3蛋白在TNBC和其他亞型乳腺癌之間的表達(dá),發(fā)現(xiàn)NFIL3蛋白在TNBC中的表達(dá)明顯高于其他亞型乳腺癌(圖1D),這與NFIL3在TNBC中的表達(dá)模式的mRNA水平相反(圖1C)。此外, NFIL3蛋白高表達(dá)與TNBC患者預(yù)后不良相關(guān)(圖1E)。
ChIP (圖1F)和雙熒光素酶報(bào)告基因 (圖1G)證明NFIL3可以結(jié)合NFIL3基因的啟動(dòng)子區(qū)域并抑制其轉(zhuǎn)錄。這表明NFIL3是NFIL3基因轉(zhuǎn)錄的抑制因子,這可能解釋了NFIL3在mRNA和蛋白水平上的相反變化。后續(xù)作者發(fā)現(xiàn)隨著外源性NFIL3蛋白的增加,NFIL3的pre-mRNA顯著下調(diào)(圖1I)。這些結(jié)果表明,NFIL3是NFIL3轉(zhuǎn)錄的一個(gè)轉(zhuǎn)錄抑制因子,并且NFIL3 mRNA的下降表明癌癥中NFIL3蛋白水平的升高。
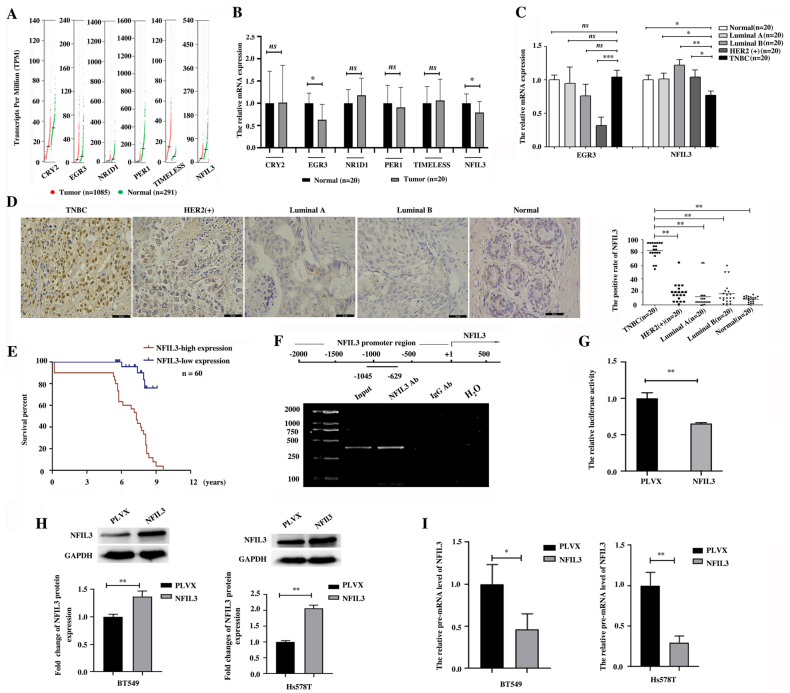
圖1 NFIL3 mRNA下降提示TNBC中NFIL3蛋白升高
2. NFIL3蛋白促進(jìn)TNBC細(xì)胞的增殖和轉(zhuǎn)移
為了檢測(cè)NFIL3蛋白在TNBC進(jìn)展中的潛在作用,分別通過(guò)功能獲得和功能缺失實(shí)驗(yàn)研究了NFIL3蛋白對(duì)兩種TNBC細(xì)胞株BT549和Hs578T增殖和轉(zhuǎn)移的影響:增加NFIL3蛋白促進(jìn)Hs578T細(xì)胞增殖(圖2A-B),而內(nèi)源性NFIL3基因的下調(diào)抑制了Hs578T細(xì)胞的增殖(圖2C, D);上調(diào)NFIL3蛋白可促進(jìn)Hs578T細(xì)胞的生長(zhǎng)(圖2E),而下調(diào)NFIL3蛋白可抑制Hs578T細(xì)胞的生長(zhǎng)(圖2F);過(guò)度NFIL3蛋白質(zhì)促進(jìn)Hs578T細(xì)胞遷移和入侵(圖2),而減少NFIL3蛋白抑制細(xì)胞遷移和入侵 (圖2 j-l);上調(diào)NFIL3蛋白可促進(jìn)Hs578T細(xì)胞的肺轉(zhuǎn)移(圖2M),而下調(diào)NFIL3蛋白可抑制Hs578T細(xì)胞的肺轉(zhuǎn)移(圖2N)。這些表明NFIL3蛋白可促進(jìn)TNBC細(xì)胞在體外和體內(nèi)的進(jìn)展。

圖2 NFIL3促進(jìn)TNBC細(xì)胞在體外和體內(nèi)的增殖和轉(zhuǎn)移
3. NFIL3調(diào)節(jié)乳腺癌中的腫瘤相關(guān)炎癥
作者使用mRNA陣列檢測(cè)了NFIL3敲除后的整體基因表達(dá)變化。功能富集分析表明,下調(diào)和上調(diào)的基因在炎癥中均顯著富集(圖3A, B)。NFIL3敲除影響的主要炎癥通路:先天免疫信號(hào)通路和適應(yīng)性免疫信號(hào)通路顯著豐富(圖3C)。基于TCGA數(shù)據(jù)集,分析NFIL3 mRNA水平與乳腺癌組織中22個(gè)炎性細(xì)胞浸潤(rùn)的相關(guān)性(圖3D-E):NFIL3 mRNA水平與I型巨噬細(xì)胞(M1)、CD4+記憶T細(xì)胞、CD8+ T細(xì)胞、樹(shù)突狀細(xì)胞(DCs)、濾泡T輔助細(xì)胞、M0細(xì)胞和中性粒細(xì)胞的浸潤(rùn)水平呈正相關(guān)(圖3D),而與Treg細(xì)胞、II型巨噬細(xì)胞(M2)、單核細(xì)胞、靜息肥大細(xì)胞、na?ve CD4+ T細(xì)胞、γδ T細(xì)胞和嗜酸性粒細(xì)胞水平呈負(fù)相關(guān)(圖3E)。此外,在60個(gè)TNBC組織中檢測(cè)了NFIL3蛋白水平與浸潤(rùn)M1、M2、CD8+T細(xì)胞數(shù)量的相關(guān)性,證實(shí)NFIL3蛋白水平與浸潤(rùn)M2細(xì)胞呈正相關(guān),與浸潤(rùn)M1細(xì)胞、CD8+T細(xì)胞呈負(fù)相關(guān)(圖3F-G)。這些結(jié)果表明,NFIL3在乳腺癌中調(diào)節(jié)腫瘤相關(guān)的炎癥。
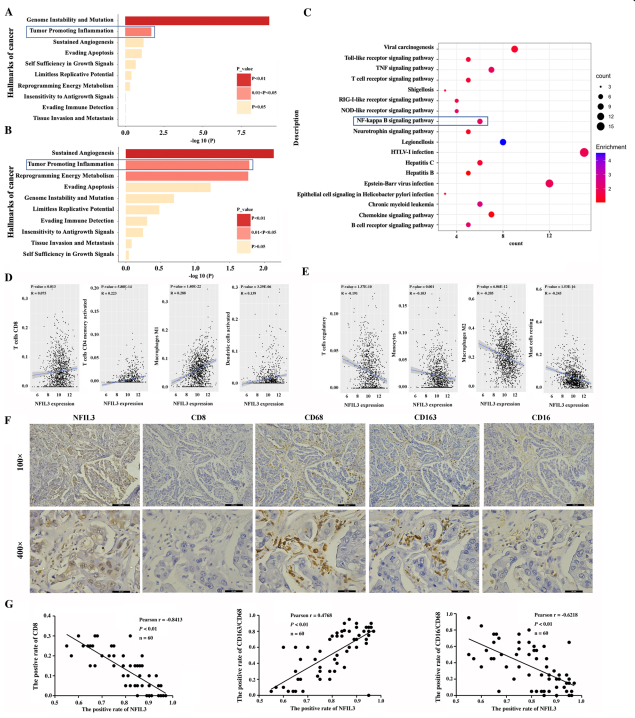
圖3 NFIL3調(diào)節(jié)乳腺癌中的癌相關(guān)炎癥
4. NFIL3通過(guò)抑制TNBC細(xì)胞中NFKBIA的表達(dá)增強(qiáng)NF κB信號(hào)通路的活性
NF-κB信號(hào)通路是一個(gè)與癌癥進(jìn)展相關(guān)的炎癥通路,在NFIL3調(diào)控的十大炎癥信號(hào)通路中富集(圖3C)。免疫熒光實(shí)驗(yàn)中,TNF-α刺激后,NF-κB迅速?gòu)募?xì)胞質(zhì)轉(zhuǎn)位至細(xì)胞核,NFIL3蛋白的過(guò)表達(dá)顯著增強(qiáng)NF-κB在不同時(shí)間點(diǎn)入核的轉(zhuǎn)位,而NFIL3蛋白的減少阻斷了NF-κB的核轉(zhuǎn)位(圖4A)。隨后,雙熒光素酶報(bào)告基因?qū)嶒?yàn)證實(shí),過(guò)表達(dá)NFIL3蛋白顯著增強(qiáng)NF-κB活性,而敲低NFIL3蛋白顯著抑制NF-κB活性(圖4B)。這些結(jié)果表明,NFIL3能有效促進(jìn)TNBC細(xì)胞NF-κB的活化。
考慮到NFIL3是一個(gè)轉(zhuǎn)錄抑制因子,NF-κB激活的典型抑制因子NFKBIA在NFIL3敲除細(xì)胞中顯著上調(diào),將NFKBIA作為NFIL3的直接靶點(diǎn)進(jìn)行進(jìn)一步研究。采用ChIP試驗(yàn)和雙熒光素酶報(bào)告基因試驗(yàn)證明,在Hs578T細(xì)胞中,NFIL3結(jié)合NFKBIA基因(圖4C)并抑制其轉(zhuǎn)錄(圖4D)。NFKBIA在NFIL3過(guò)表達(dá)細(xì)胞中下降,但在NFIL3敲除細(xì)胞中,在Hs578T細(xì)胞(圖4E-F)。此外,免疫組化檢測(cè)乳腺癌組織中NFIL3和NFKBIA的蛋白水平,發(fā)現(xiàn)乳腺癌組織中NFIL3蛋白水平與NFKBIA蛋白水平呈負(fù)相關(guān)(圖4G)。TCGA數(shù)據(jù)集中NFIL3和NFKBIA的相關(guān)性,發(fā)現(xiàn)NFIL3 mRNA與NFKBIA mRNA在乳腺癌(圖4H)中均呈正相關(guān)。這些結(jié)果表明NFKBIA是NFIL3蛋白的直接靶點(diǎn),在TNBC細(xì)胞中被NFIL3轉(zhuǎn)錄抑制。

圖4 NFIL3增強(qiáng)NF-κB信號(hào)通路活性,抑制TNBC細(xì)胞中NFKBIA的轉(zhuǎn)錄
5. NFKBIA抑制NF-κB信號(hào)通路的活性,抑制TNBC細(xì)胞在體內(nèi)外的增殖和轉(zhuǎn)移
NF-κB基因的下調(diào)增強(qiáng)了NF-κB從細(xì)胞質(zhì)進(jìn)入細(xì)胞核的易位,而NFKBIA的過(guò)表達(dá)阻斷了Hs578T細(xì)胞中NF-κB的核易位(圖5A)。NF-κB活性顯著增強(qiáng),而NF-κB過(guò)表達(dá)顯著抑制NF-κB活性(圖5B)。此外,基于TCGA數(shù)據(jù)集,分析NFKBIA mRNA水平與乳腺癌組織中22個(gè)炎癥細(xì)胞浸潤(rùn)的相關(guān)性(圖5C, D),發(fā)現(xiàn)NFKBIA mRNA水平與M1、CD4+ T細(xì)胞、CD8+ T細(xì)胞和na?ve B細(xì)胞的浸潤(rùn)水平呈正相關(guān)(圖5C),而根據(jù)TCGA數(shù)據(jù)集,與乳腺癌組織中M2細(xì)胞、靜息肥大細(xì)胞和嗜酸性粒細(xì)胞浸潤(rùn)水平呈負(fù)相關(guān)(圖5D)。通過(guò)免疫組化檢測(cè),乳腺癌組織中NFKBIA蛋白水平與M1、M2和CD8+ T細(xì)胞浸潤(rùn)量的相關(guān)性也得到了證實(shí)(圖5E, F)。這些結(jié)果表明,NFKBIA是NF-κB信號(hào)通路的抑制因子,與NFIL3不同,它調(diào)控TNBC中腫瘤相關(guān)的炎癥反應(yīng)。
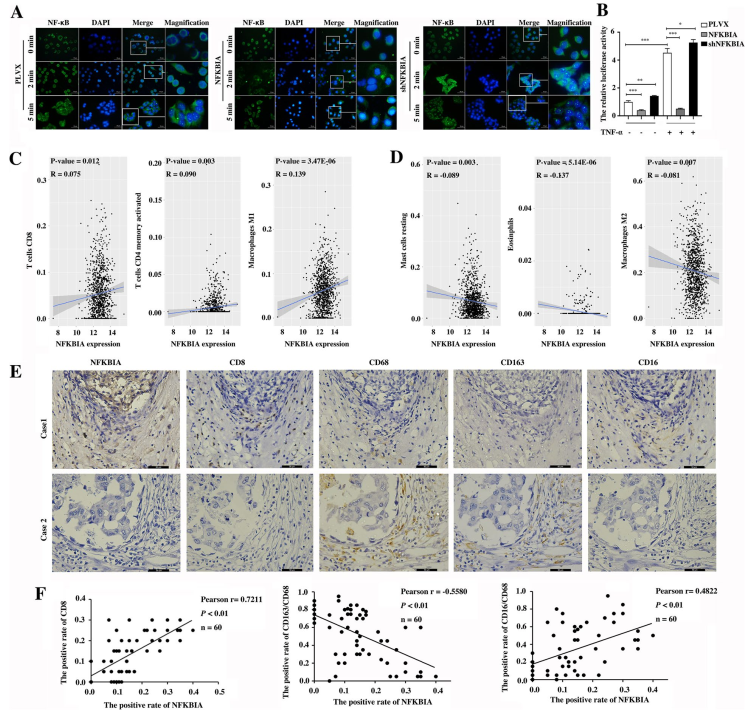
圖5 NFKBIA抑制NF-κB信號(hào)通路的活性,并與乳腺癌免疫細(xì)胞的浸潤(rùn)相關(guān)
接下來(lái),通過(guò)細(xì)胞計(jì)數(shù)和克隆形成實(shí)驗(yàn),發(fā)現(xiàn)過(guò)表達(dá)NFKBIA抑制了細(xì)胞增殖,而下調(diào)NFKBIA則促進(jìn)了Hs578T細(xì)胞(圖6A-D)。NFKBIA的過(guò)表達(dá)抑制了皮下Hs578T腫瘤的生長(zhǎng)(圖6E),而NFKBIA的下調(diào)促進(jìn)了裸鼠皮下Hs578T腫瘤的生長(zhǎng)(圖6F)。此外,過(guò)表達(dá)NFKBIA不僅在體外抑制Hs578T細(xì)胞(圖6G-I)的遷移和侵襲,而且在小鼠尾靜脈注射模型中降低Hs578T細(xì)胞的肺轉(zhuǎn)移(圖6J)。下調(diào)NFKBIA基因可促進(jìn)Hs578T細(xì)胞(圖6K-M)在體外的遷移和侵襲,并增強(qiáng)Hs578T細(xì)胞在體內(nèi)的轉(zhuǎn)移(圖6N)。這些結(jié)果表明,NFKBIA與致癌的NFIL3不同,是一種抑制乳腺癌細(xì)胞進(jìn)展的腫瘤抑制因子。
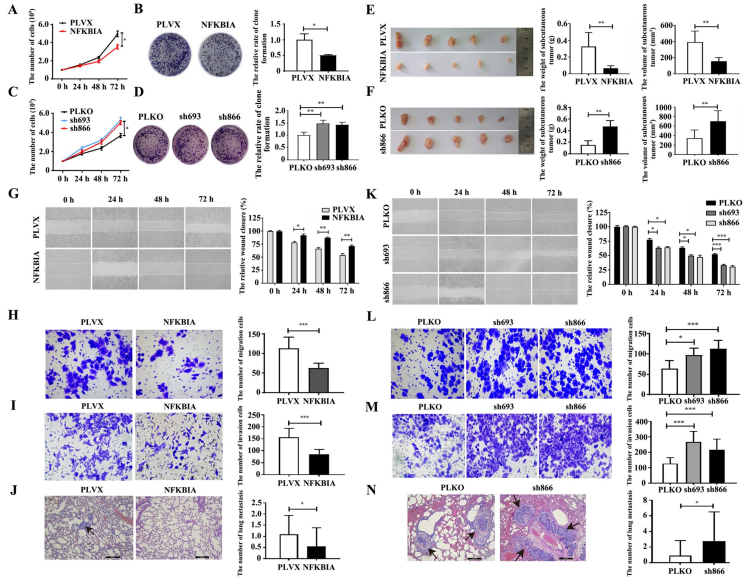
圖6 NFKBIA抑制TNBC細(xì)胞的增殖和轉(zhuǎn)移
6. NFIL3通過(guò)抑制NFKBIA促進(jìn)NF κB的激活和乳腺癌的進(jìn)展
為了進(jìn)一步評(píng)價(jià)NFKBIA在介導(dǎo)NFIL3對(duì)NF-κB激活和TNBC進(jìn)展的影響中的關(guān)鍵作用,在Hs578T(圖7A)細(xì)胞中過(guò)表達(dá)NFKBIA和NFIL3,并檢測(cè)了NFKBIA和NFIL3過(guò)表達(dá)對(duì)NF-κB活性和乳腺癌細(xì)胞株的增殖、遷移和侵襲的影響。在過(guò)表達(dá)NFIL3的乳腺癌細(xì)胞中拯救NFKBIA的表達(dá),可以阻斷Hs578T細(xì)胞中NFIL3過(guò)表達(dá)引發(fā)的NF-κB從細(xì)胞質(zhì)到細(xì)胞核的快速易位(圖7B)。雙熒光素酶報(bào)告實(shí)驗(yàn)證實(shí),挽救NFKBIA的表達(dá)抑制了NFIL3對(duì)NF-κB活性的促進(jìn)作用(圖7C)。NFKBIA的表達(dá)部分逆轉(zhuǎn)了NFIL3對(duì)Hs578T細(xì)胞(圖7D)的增殖促進(jìn)作用,以及對(duì)Hs578T細(xì)胞(圖7E, F)的遷移和侵襲促進(jìn)作用。這些表明NFIL3通過(guò)抑制NFKBIA進(jìn)而增強(qiáng)NF-κB信號(hào)通路的活性,從而促進(jìn)TNBC的進(jìn)展。
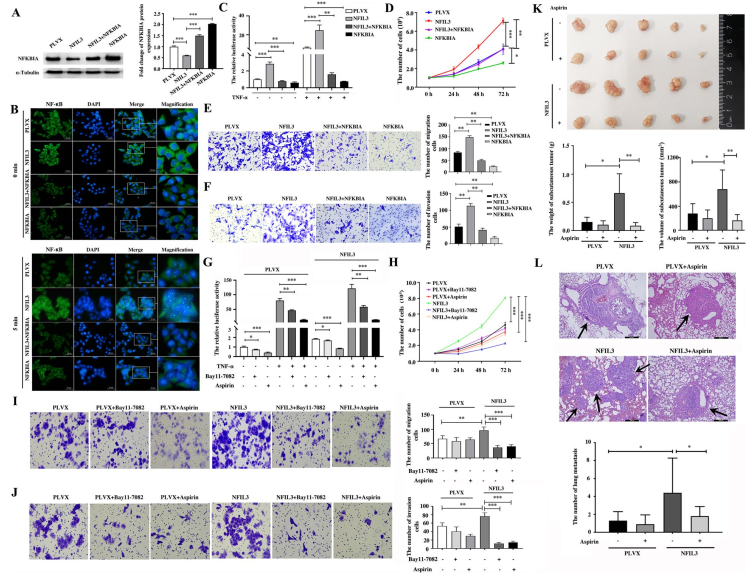
圖7 NFIL3通過(guò)抑制NFKBIA,激活NF-κB炎癥通路,促進(jìn)TNBC細(xì)胞的增殖、遷移和侵襲
7. 針對(duì)NF-κB活性的抗炎策略阻斷了NFIL3蛋白在TNBC中的致癌作用
雙熒光素酶報(bào)告實(shí)驗(yàn)檢測(cè)到,阿司匹林和Bay11-7082不僅顯著阻斷了NFIL3蛋白介導(dǎo)的NF-κB信號(hào)通路的激活(圖7G),而且顯著抑制了NFIL3對(duì)Hs578T細(xì)胞增殖、遷移和侵襲的促進(jìn)作用(圖7H-J)。此外,阿司匹林顯著抑制了NFIL3對(duì)裸鼠Hs578T細(xì)胞生長(zhǎng)(圖7K)和轉(zhuǎn)移(圖7L)的促進(jìn)作用。綜上所述,針對(duì)NF-κB活性的方法可阻斷了NFIL3蛋白在TNBC中的致癌作用。
主要結(jié)論:
與正常乳腺組織及其他亞型乳腺癌相比,NFIL3蛋白在TNBC中均升高,并通過(guò)抑制NFKBIA的表達(dá),激活NF-κB信號(hào)通路,促進(jìn)TNBC細(xì)胞的進(jìn)展。針對(duì)NF-κB活性的抗炎策略阻斷了NFIL3在TNBC中的致癌作用。本研究可能為TNBC的防治提供新的靶點(diǎn)。






