SUMOylation促進細胞外囊泡介導的lncRNA ELNAT1的傳遞和膀胱癌的淋巴結轉移

小泛素修飾(SUMO)結合稱為SUMO修飾,其作為生物活性分類的誘導劑分子進入細胞外囊泡(EVs),觸發淋巴管生成,進一步驅動腫瘤淋巴結(LN)轉移,但確切的機制仍不清楚。本研究發現,SUMOylation促進細胞外囊泡介導的lncRNA ELNAT1的傳遞和膀胱癌的淋巴結轉移。該文于2021年4月發表在《The Journal of Clinical Investigation》IF: 14.808。
技術路線:

結果:
1. SUMOylation參與膀胱癌的淋巴結轉移
為了探討SUMOylation在膀胱癌(BCa)的淋巴結(LN)轉移中的作用,作者基于淋巴癌與TCGA數據庫中比較SUMOylation的表達譜,發現BCas中UBC9的高表達,同時生成分析顯示,與UBC9表達較低的患者相比,UBC9表達較高的患者總生存率(OS)和無病生存期(DFS)較低(Figure 1 A-E)。為了證明UBC9在LN轉移中的作用,作者通過242例的BCas患者樣本,發現UBC9在LN轉移過程中高表達(Figure 1 F)。接下來為了證明,SUMOylation對BCas誘導的淋巴內皮管的形成和遷移作用,通過其特異性抑制劑阻斷SUMOylation (2D-08)明顯抑制了該誘導過程(Figure 1 G-I)。以上數據表明,UBC9異常高表達與膀胱癌進展和淋巴結轉移正相關,SUMOylation參與膀胱癌的淋巴結轉移。
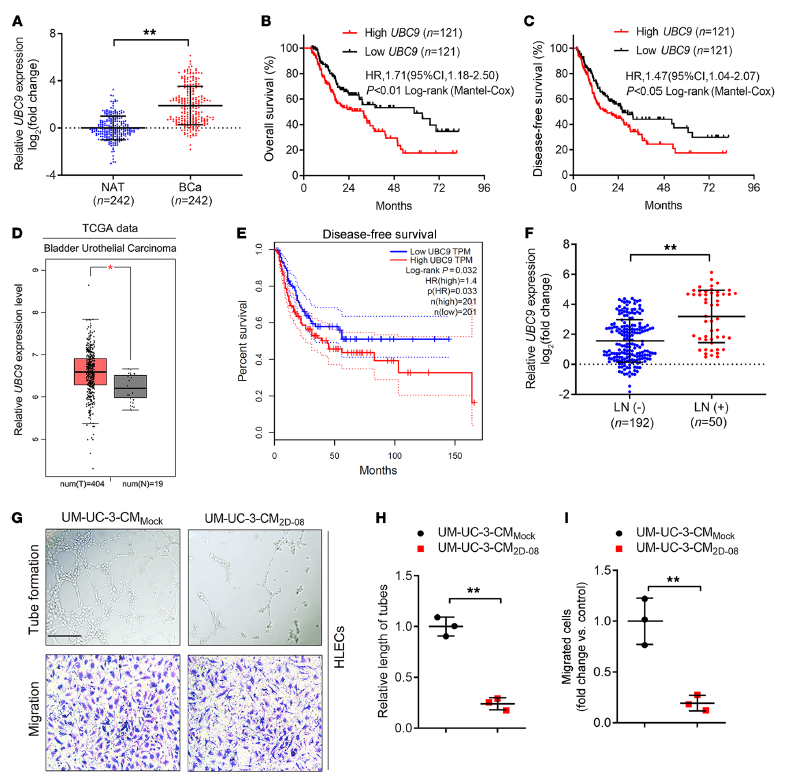
Figure 1 SUMOylation參與膀胱癌的淋巴結轉移
2. EVs介導的ELNAT1過表達與淋巴結轉移相關
EVs介導的lncRNA轉運是腫瘤細胞與TME之間通過信號轉導發生的一個關鍵過程。作者采集各5例的健康志愿者與BCas患者的尿液,通過NGS測序確定了EVs中lncRNA的整體表達譜,結合與SUMOylation途徑的相關性,最終篩選出EVs中異常高表達的lncRNA ELNAT1(Figure 2 A, B)。結合BCa與LN轉移,ELNAT1在BCa與LN轉移中高表達(Figure 2 C, D),并且ELNAT1過表達與BCa患者預后不良相關(Figure 2 E, F)。另外,在瘤內和瘤旁區域ELNAT1的表達與淋巴管密度正相關(Figure 2 G, H),提示ELNAT1廣泛參與BCa的淋巴管生成。
為了證明ELNAT1與BCa分泌的EV的關系,作者從BCa細胞培養基中分離出EVs,采用透射電子顯微鏡(TEM)、納米粒子跟蹤分析(NTA)及對EVs的蛋白標志物檢測,證明了作者準確分離出BCa分泌的EV(Figure 2 J-L)。并且從BCa患者和健康志愿者尿液樣本中分離的EVs中檢測ELNAT1的表達,發現ELNAT1在BCa分泌的EV中過表達(Figure 2 I)。以上數據表明,EVs介導的ELNAT1過表達與淋巴結轉移相關。
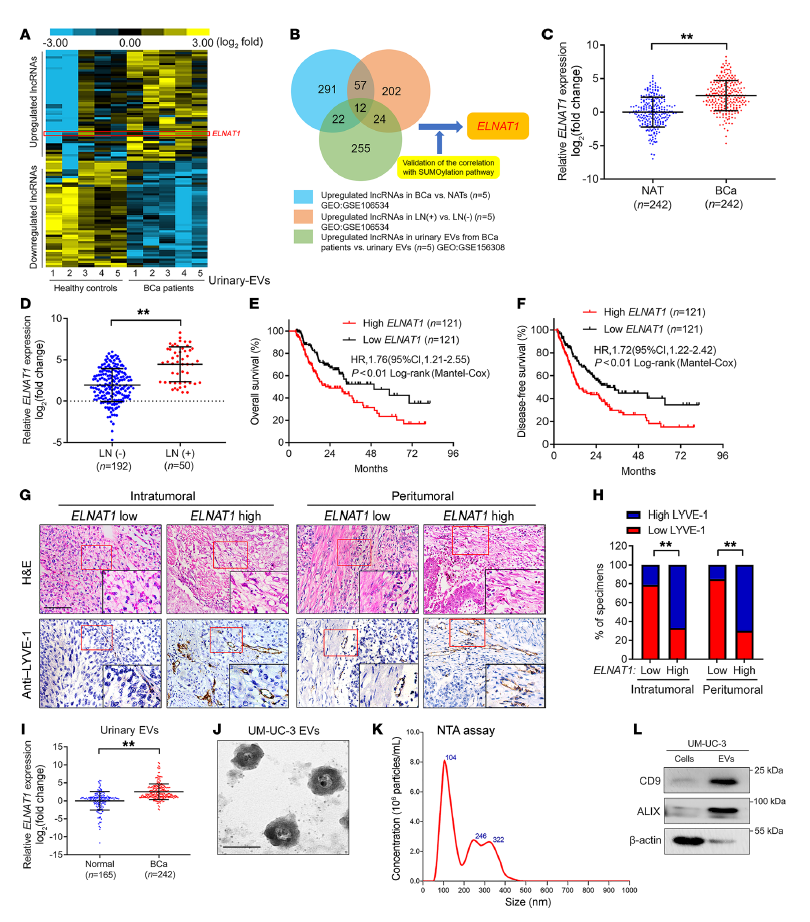
Figure 2 EVs介導的ELNAT1過表達與淋巴結轉移相關
3. EVs介導的ELNAT1促進BCa體內外淋巴管生成和淋巴轉移
為了確定EV介導的ELNAT1是否促進體外淋巴管生成,作者用HLECs孵育BCa細胞分泌的EVs的檢測管形成和遷移。研究發現,干擾ELNAT1基因會破壞UM-UC-3和T24細胞分泌EVs誘導HLECs管形成和遷移的能力(Figure 3 A-C),這些結果表明EVs介導的ELNAT1誘導了體外淋巴管生成。
為了確定EVs介導的ELNAT1在體內促進LN轉移,首先構建一個小鼠腘窩的淋巴結轉移模型。小鼠隨機分為2組(n = 12),每3天接受由載體(UM-UC-EV Vector)或ELNAT1(UM-UC-3-EV ELNAT1)轉染的UM-UC-3細胞分泌的EVs 瘤內注射,當原發腫瘤大小達到200mm3時采集腫瘤和腘窩的LNs(Figure 3D)。結果發現,通過體內成像系統(IVIS)發現,與UM-UC-EV Vector相比,UM-UC-3-EV ELNAT1促進了UM-UC-3細胞向腘窩LNs的轉移,LNs體積更大(Figure 3 E- I)。
由于淋巴管生成是淋巴結轉移的關鍵步驟,因此進一步評估了EVs介導的ELNAT1在體內對淋巴管生成的影響。結果顯示,UM-UC-3-EV ELNAT1組顯著增加了小鼠足底腫瘤瘤內和瘤旁區域的淋巴管內皮透明質酸受體1陽性(LYVE-1 positive)(Figure 3 J, K)。以上結果表明,EVs介導的ELNAT1促進BCa體內淋巴管生成和淋巴結轉移。

Figure 3 EVs介導的ELNAT1促進BCa體內外淋巴管生成和淋巴轉移
4. ELNAT1直接與hnRNPA1相互作用
由于lncRNA的分子功能與其亞細胞定位相關,通過FISH和亞細胞定位實驗發現ELNAT1在UM-UC-3 和T24 細胞的細胞質和細胞核均有表達(Supplemental Figure7 A, B)。并且通過RNA-pull down實驗,發現在分子量35~40 kDa上有明顯的條帶(Figure 4 A)。對此,通過質譜(MS)和Western blot分析顯示,hnRNPA1是最豐富的ELNAT1相互作用蛋白(Figure 4 B-D)。熒光染色和RNA免疫沉淀(RIP)證實了ELNAT1和hnRNPA1在UM-UC-3和T24細胞中的共定位,并且ELNAT1通過內源性hnRNPA1富集(Figure 4 E, F),進一步驗證了ELNAT1和hnRNPA1之間的相互作用。
此外,為進一步驗證ELNAT1與hnRNPA1相互作用區域,使用ELNAT1不同序列缺失進行RNA-pull down分析,以評估ELNAT1和hnRNPA1結合所需的區域。結果發現,ELNAT1序列中600-750 nt位置是其與hnRNPA1交互作用區域(Figure 4 G, H)。并通過POSTAR2預測ELNAT1在610-680 nt區域的莖環結構可能被hnRNPA1識別(Figure 4 I),而當這一區域缺失時,hnRNPA1減弱對ELNAT1的富集(Figure 4 J)。因此,這表明這些特定的序列(610-680 nt)對ELNAT1 hnRNPA1的相互作用至關重要。
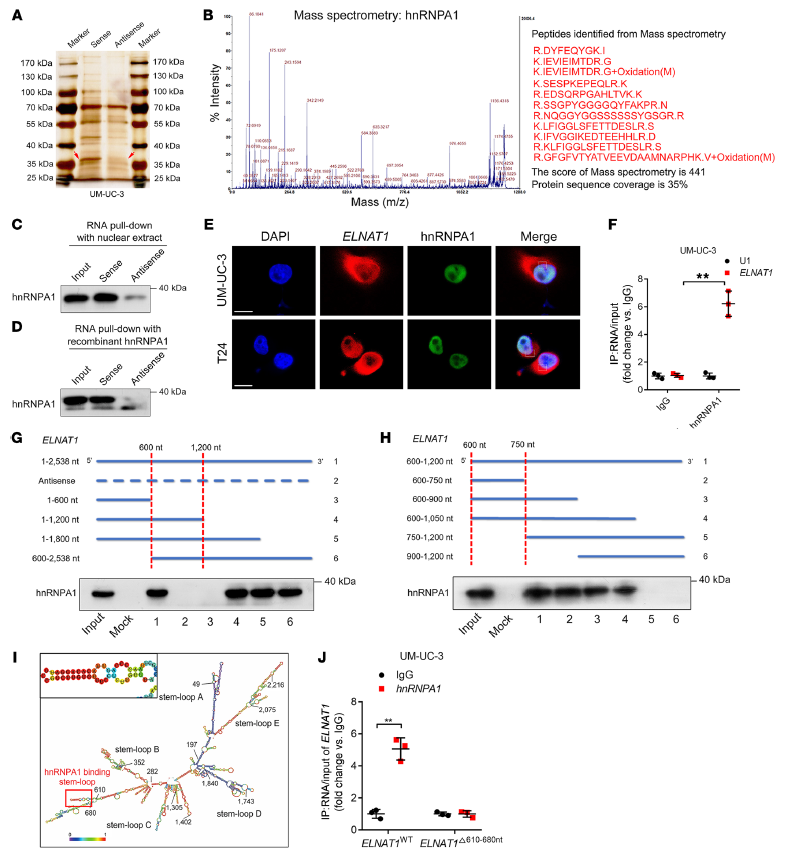
5. ELNAT1與UBC9啟動子形成DNA-RNA三聯體,通過招募hnRNPA1增強H3K4me3修飾
為了探索ELNAT1誘導BCa淋巴轉移的分子機制,我們使用NGS檢測過表達ELNAT1的BCa細胞和對照細胞(Figure 5 A),由于SUMOylation已經被證明可以調節特異性RNA的識別,并參與RNA分選進入EVs的過程,因此鑒定ELNAT1的SUMOylation相關靶基因。在受ELNAT1調控的925個基因中,作者發現UBC9是SUMOylation相關基因變化最顯著的(Figure 5 B-D)。接著通過RNA純化(ChIRP)檢驗ELNAT1與UBC9中P1(153 ~ 143 bp)啟動子區域存在生理相互作用(Figure 5 E, F)。CD光譜證實ELNAT1/UBC9 TTS1組在270 ~ 280 nm處有一個顯著的正峰,在210 nm處有一個負峰。在FENDRR/PITX2陽性對照組中也有類似的發現(Figure 5 G, H)。FRET技術分析顯示, 與ELNAT1 / UBC9 TTS1組相比,熒光強度發生了巨大的變化:從520 nm到570–580 nm,熒光強度控制單鏈RNA / UBC9 ssRNA / UBC9 TTS1集團,這與FENDRR / PITX2陽性對照組類似(Figure 5 I, J)。
此外,ChIP分析顯示,過表達ELNAT1增加了hnRNPA1和組蛋白甲基化(H3K4me3)在UBC9啟動子上的富集,而通過刪除hnRNPA1的ELNAT1結合位點則抑制了富集(Figure 5 K, L)。同時,ELNAT1沉默顯著降低了UM-UC-3和T24細胞UBC9啟動子的hnRNPA1占用率和H3K4me3甲基化(Figure 5 M, N),這證明了hnRNPA1通過調節UBC9啟動子上的組蛋白甲基化,促進ELNAT1誘導UBC9的轉錄激活。以上結果說明,ELNAT1與UBC9啟動子形成DNA-RNA三聯體,通過招募hnRNPA1增強H3K4me3修飾。
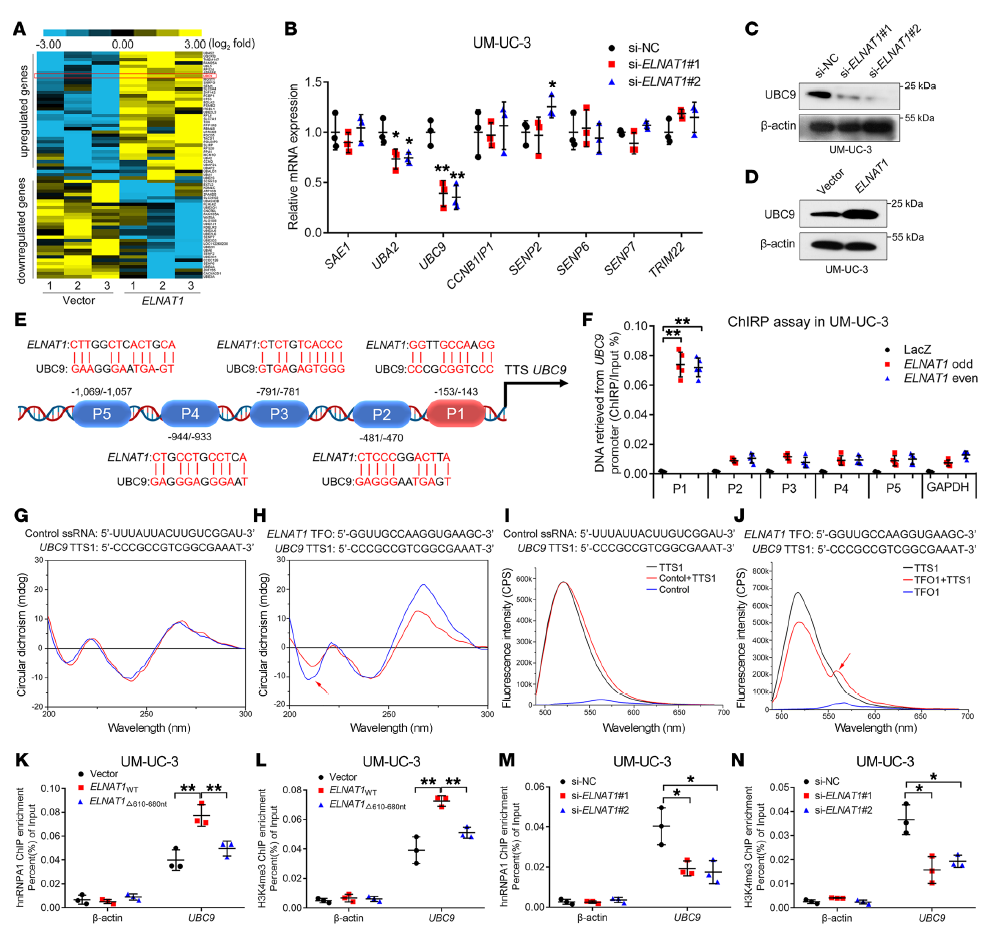
Figure 5 ELNAT1與UBC9啟動子形成DNA-RNA三聯體,通過招募hnRNPA1增強H3K4me3修飾
6. ELNAT1通過UBC9誘導的hnRNPA1的SUMOylation被封裝到EVs中
UBC9可以催化靶蛋白的SUMOylation來調節它們與生物分子的相互作用和細胞運輸。Figure 6 A顯示,通過co-IP分析,觀察到一個明顯的15~25 kDa條帶被hnRNPA1特異性富集。此外,IP分析顯示UBC9過表達增強了hnRNPA1的SUMO2連接,表明UBC9誘導hnRNPA1的SUMOylation(Figure 6 B)。將hnRNPA1中SUMOylation修飾的位點賴氨酸3 (K3)和賴氨酸113 (K113)用精氨酸替代(Figure 6 C),并通過co-IP分析表明,證明了hnRNPA1中SUMOylation修飾的位點是K113(Figure 6 D)。ELNAT1過表達上調了hnRNPA1K113的SUMO化,而敲除UBC9則消除了這個影響(Figure 6 E)。
另外,之前報道過hnRNPA1將miR-196a和miR-320加載到EVs中,本研究ELNAT1表現出的EVs-細胞比率與miR-196a和miR-320相當(Figure 6 F)。hnRNPA1沉默顯著抑制了ELNAT1在BCa細胞分泌的EVs中的富集(Figure 6 G)。此外,缺失的ELNAT1(包含hnRNPA1結合位點的610-680 nt)主要保留在BCa細胞中(Figure 6 H),證實了ELNAT1通過與hnRNPA1的相互作用被加載到EVs中。
驗證SUMOylation是否有助于hnRNPA1介導的EVs包裹ELNAT1。在BCa細胞中,hnRNPA1中K113位點突變使BCa細胞分泌的EVs中ELNAT1表達降低,沉默UBC9降低了BCa細胞分泌的EVs中ELNAT1的富集(Figure 6 I, J)。與hnRNPA1 WT沉默相比,hnRNPA1沉默后,轉染hnRNPA1K113R并不能恢復EVs介導的ELNAT1下調(Figure 6 K)。共聚焦顯微鏡顯示,在UBC9沉默或hnRNPA1K113R突變后,ELNAT1在CD36標志的多囊泡(MVBs)中的積累明顯下降(Figure 6 L),表明ELNAT1進入EVs受hnRNPA1的SUMO化調控。
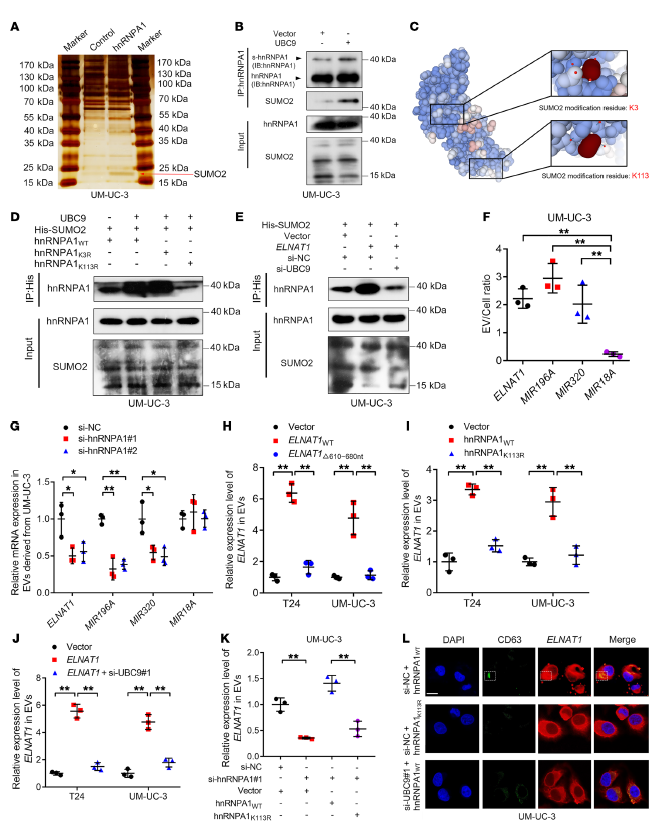
Figure 6 ELNAT1通過UBC9誘導的hnRNPA1的SUMOylation被封裝到EVs中
7. EVs介導的ELNAT1被HLECs內化以誘導淋巴管生成
共聚焦顯微鏡顯示HLECs中PKH67標記EVs孵育后的點狀熒光強度(Figure 7 A),表明HLECs內化了BCa分泌的EVs。此外,孵化UM-UC-3-EVELNAT1顯著上調HLECs中ELNAT1表達,而孵化T24-EVsi-ELNAT1,則T24細胞分泌的EVs中ELNAT1表達下調,則削弱了HLECs中EVs誘導ELNAT1過表達的能力(Figure 7 B, C)。
為了排除淋巴血管生成是由內源性ELNAT1激活HLECs中誘導的可能性,構建了ELNAT1-KO HLECS ELNAT1(HLECsELNAT1-KO)模型(Figure 7 D, E)。與HLECsELNAT1-WT一致,我們觀察到,EVs介導的ELNAT1過表達增強了HLECsELNAT1-KO的管狀形成和遷移能力,而下調ELNAT1則抑制了BCa細胞分泌EVs誘導HLECsELNAT1-KO管狀形成和遷移的能力(Figure 7 F-H)。這表明BCa細胞分泌的EVs通過運輸EVs介導的ELNAT1促進淋巴管生成,而不是轉錄激活內源性的ELNAT1。綜上所述,這些結果表明EVs介導的ELNAT1被HLECs內化誘導BCa淋巴管生成。
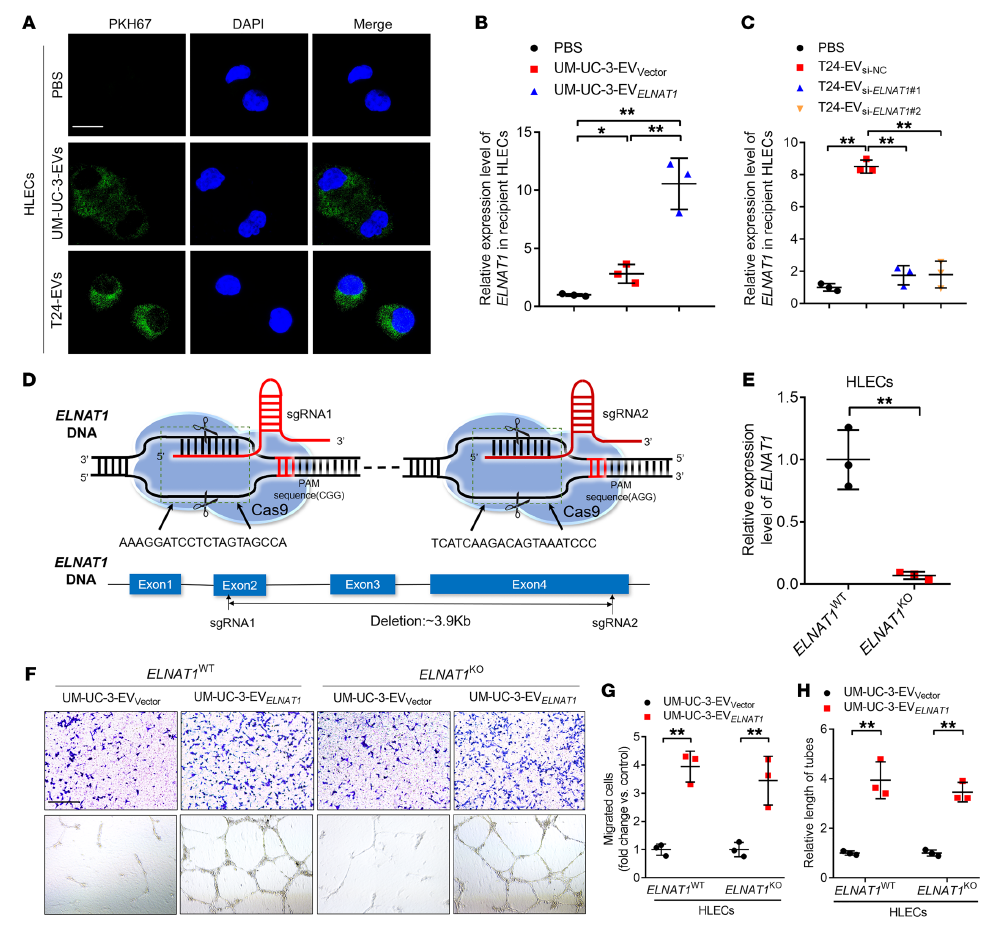
Figure 7 EVs介導的ELNAT1被HLECs內化以誘導淋巴管生成
8. EVs介導的ELNAT1上調HLECs中SOX18的表達
qRT-PCR分析UM-UC-3-EV1載體或UM-UC-3-EVELNAT1處理的HLECs中淋巴管生成相關基因的表達,結果顯示SRY-box轉錄因子18 (SOX18)是最明顯的與EVs介導的ELNAT1表達正相關的基因(Figure 8 A, B)。此外,ChIRP分析表明EVs介導的ELNAT1與HLECs中SOX18啟動子的771~786 bp(p4)直接相互作用(Figure 8 C, D)。SOX18-p4區域的突變降低了EVs介導的ELNAT1誘導的熒光素酶活性(Figure 8 E, F),表明SOX18-p4對于EVs介導的ELNAT1誘導HLECs中SOX18的上調至關重要。hnRNPA1和H3K4me3在SOX18啟動子上的富集與EVs介導的ELNAT1表達顯著相關(Figure 8 G, J)。EVs介導的ELNAT1過表達增強了HLECs的管形成和遷移能力,而干擾SOX18則HLECs的管形成和遷移能力受損(Figure 8 K, M),表明SOX18是EVs介導的ELNAT1驅動體外BCa淋巴管生成所必需的。綜上所述,這些結果表明,EVs介導的ELNAT1通過轉錄上調HLECs中SOX18的表達來促進BCa淋巴管生成。
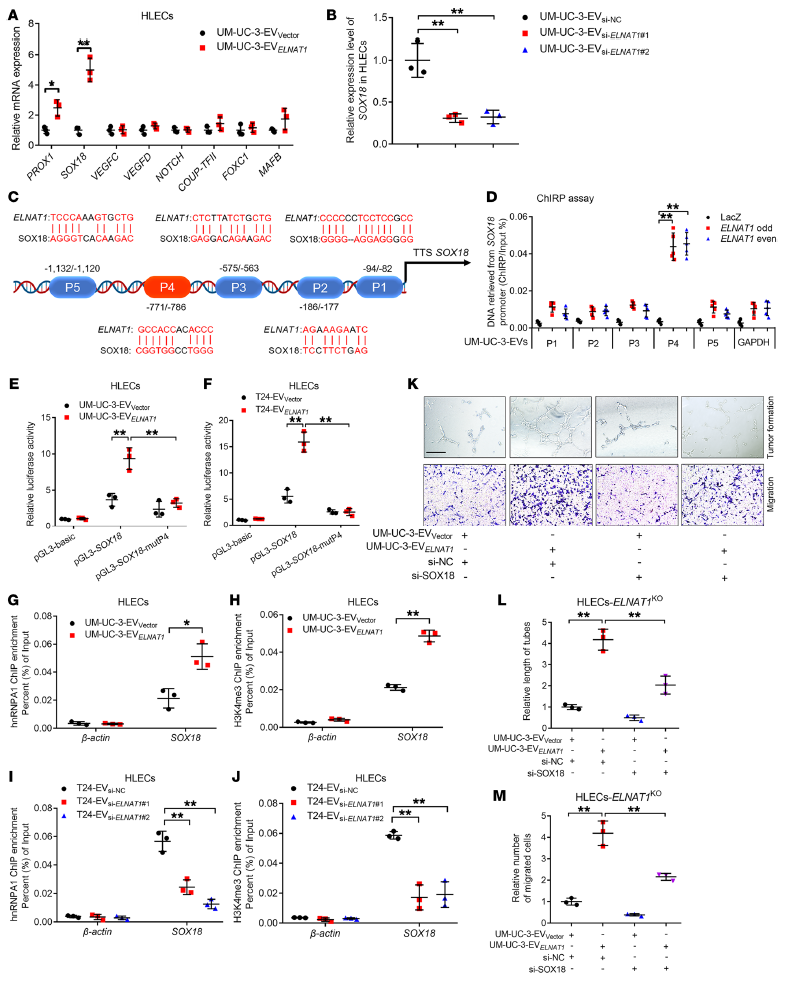
Figure 8 EVs介導的ELNAT1上調HLECs中SOX18的表達
9. 阻斷SUMOylation抑制EVs介導的ELNAT1誘導的淋巴結轉移
用si-NC或si-UBC9#1轉染的對照或ELNAT1過表達UM-UC-3細胞分泌的EVs處理HLECs,結果顯示過表達ELNAT1顯著促進了體外BCa細胞分泌的EVs誘導淋巴血管生成,而沉默UBC9逆轉了這一作用(Figure 9 A-C)。IVIS證明UM-UC-3-EVELNAT1增強了體內腘窩淋巴結轉移,而沉默UBC9抑制了這種作用(Figure 9 D, E)。UM-UC-3-EVELNAT1+ siUBC9 #1組的腘窩LNs體積比UM-UC-3-EVELNAT1組小(Figure 9 F)。與UM-UC-3-EVVector組相比,UM-UC-3-EVELNAT1增加了小鼠足底腫瘤的淋巴管數量,而下調UBC9的表達導致EVs介導的ELNAT1誘導的淋巴管數量逐漸減少(Figure 9 G, H)。此外, UM-UC-3-EVELNAT1+si-UBC9#1組的LN生成時間長于UM-UC-3-EVELNAT1組(Figure 9 I)。綜上所述,這些結果表明UBC9誘導的SUMOylation抑制EVs介導的ELNAT1誘導的BCa淋巴管生成和LN轉移。

Figure 9阻斷SUMOylation抑制EVs介導的ELNAT1誘導的淋巴結轉移
10. EVs介導的ELNAT1與BCa淋巴結轉移相關
確定EVs介導的ELNAT1在BCa淋巴結轉移中的臨床意義十分重要。首先,作者發現來自BCa患者的尿中EVs與配對BCa組織的ELNAT1表達呈正相關,這意味著EVs介導的ELNAT1是BCa中ELNAT1調控的重要參與者(Figure 10 A)。同時,BCa患者的尿中EV介導的ELNAT1過表達與BCa的淋巴結轉移呈正相關(Figure 10 B)。EV介導的ELNAT1表達較高的BCa患者總生存期(OS)和無病生存期(DFS)率較短(Figure 10 C-D)。ROC分析顯示尿液中EV介導的ELNAT1可有效區分BCa患者與健康志愿者 (Figure 10 E)。與尿液細胞學和FISH檢查結果相比,尿液中EVs介導的ELNAT1診斷BCa-LN轉移的準確性很高(Figure 10 F)。BCa患者血清中EVs介導的ELNAT1表達水平高于健康對照組(Figure 10 G)。與無淋巴結轉移的BCa患者血清相比,伴有淋巴結轉移的BCa患者血清中EVs介導的ELNAT1表達上調(Figure 10 H)。
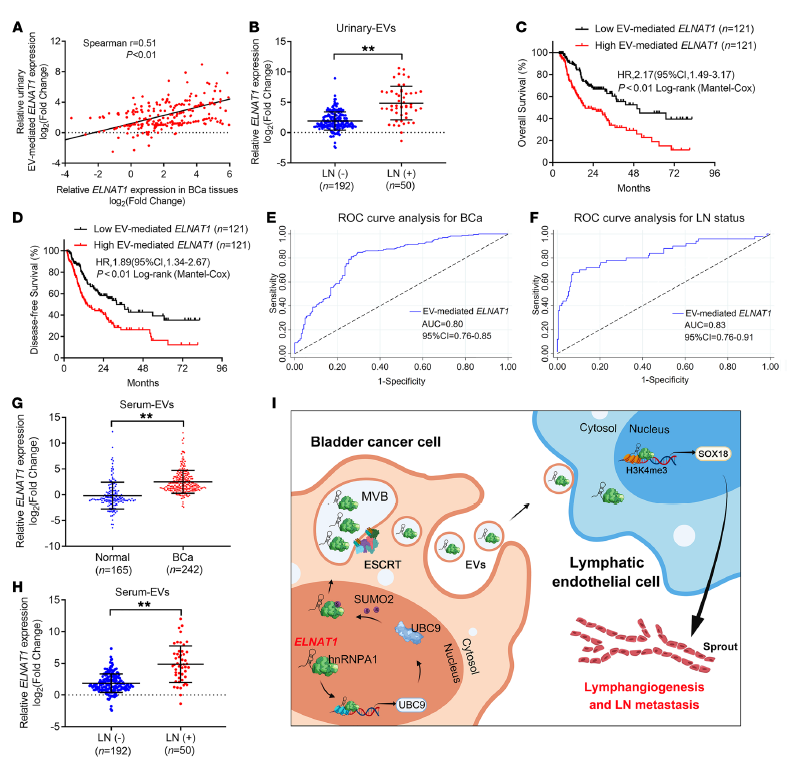
Figure 10 EVs介導的ELNAT1與BCa淋巴結轉移相關
結論:EVs介導的ELNAT1促進了BCa的淋巴管生成和淋巴結轉移。充分闡明EVs介導的ELNAT1激活hnRNPA1/UBC9/ SOX18軸誘導BCa淋巴結轉移的精確機制,不僅將增加我們對EVs介導的淋巴結轉移的認識,也將有助于開發一種治療BCa的有效策略。






