治療有望:間充質(zhì)干細胞移植促進CD4+T細胞衰老改善紅斑狼瘡
人類人臍帶來源的間充質(zhì)干細胞(hUC-MSCs)移植被證實是治療系統(tǒng)性紅斑狼瘡(SLE)的有效方法,但是詳細的潛在機制仍不明確。轉(zhuǎn)運miRNAs可能是MSCs交流其它細胞的方法。Sirt1是一種NAD依賴的去乙酰化酶,通過去乙酰化p53來防止細胞衰老。本研究旨在探討在MRL/lpr狼瘡小鼠模型中,hUC-MSCs是否通過miRNA調(diào)節(jié)Sirt1/p53來影響脾CD4+ T細胞的衰老。本文于2021年1月發(fā)表在《Theranostics》IF:8.597期刊上。
技術(shù)路線

主要實驗結(jié)果
為了評估對MRL/lpr小鼠狼瘡綜合征的治療作用,從17周齡開始用5 × 105 hUC-MSCs或PBS治療MRL/lpr小鼠,并在21周齡時處死所有小鼠(圖1A)。與PBS處理的小鼠相比,hUC - MSC處理的小鼠的腎臟病變明顯減少(圖1B)。此外,與PBS處理的MRL/lpr小鼠相比,hUC-MSCs處理后小鼠的脾臟重量和蛋白尿明顯降低 (圖1C - D)。hUC - MSCs治療組的血清anti-dsDNA抗體水平較低,但未達到統(tǒng)計學水平 (圖1E)。數(shù)據(jù)表明hUC-MSCs改善MRL/lpr小鼠的狼瘡疾病。
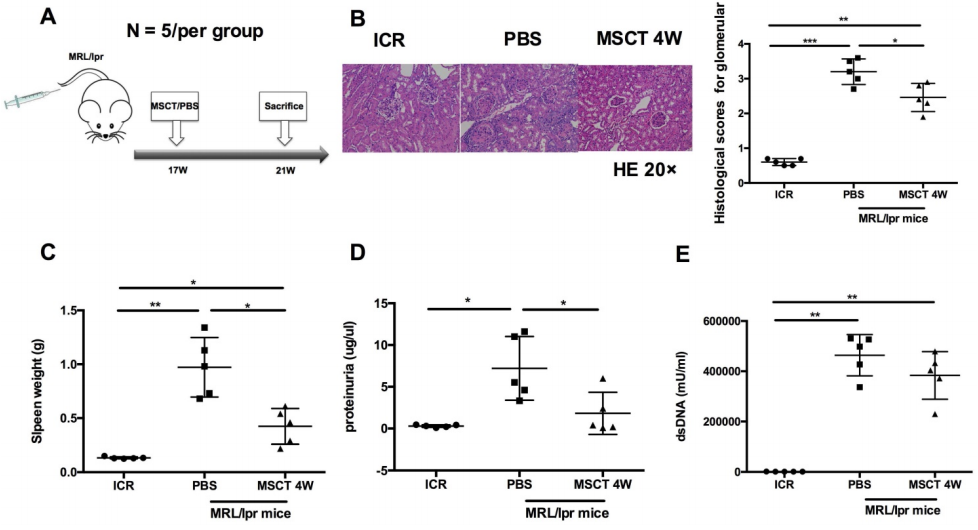
圖1 hUC-MSCs減輕緩解MRL/lpr小鼠的疾病進展
2、hUC-MSCs增加MRL/lpr小鼠脾CD4+ T細胞的衰老通過Sirt1/p53信號
作者推測hUC-MSCs治療MRL/lpr小鼠的潛在機制可能是通過增強CD4+ T細胞的衰老來抑制其積累。為了驗證這一點,作者從脾細胞懸液中分離出單核細胞,然后純化CD4+ T細胞用于RNA和蛋白質(zhì)制備。測量了p21和p16水平作為早衰的標記物。結(jié)果顯示與WT對照組相比,p21和p16的mRNA和蛋白質(zhì)水平在MRL/lpr小鼠中顯著降低,與此同時,與接受PBS處理的MRL/lpr小鼠相比, p21和p16的mRNA和蛋白表達在hUC-MSCs治療組中顯著增加 (圖2A-C)。研究還發(fā)現(xiàn),與WT小鼠相比,MRL/lpr脾臟CD4+ T細胞的Sirt1表達水平升高,在Lys-379位點的p53乙酰化水平降低,而hUC-MSCs治療可以通過降低Sirt1水平、增加p53水平和p53乙酰化水平來逆轉(zhuǎn)這一變化(圖2C - E)。總之,上述結(jié)果提示,MRL/lpr小鼠脾臟CD4+ T細胞的衰老可能是有缺陷的由于Sirt1/p53的信號改變導致,這可能導致CD4+ T細胞的過度增殖。因此,hUC-MSCs的臨床作用可能與脾CD4+ T細胞衰老通路的恢復有關(guān)。
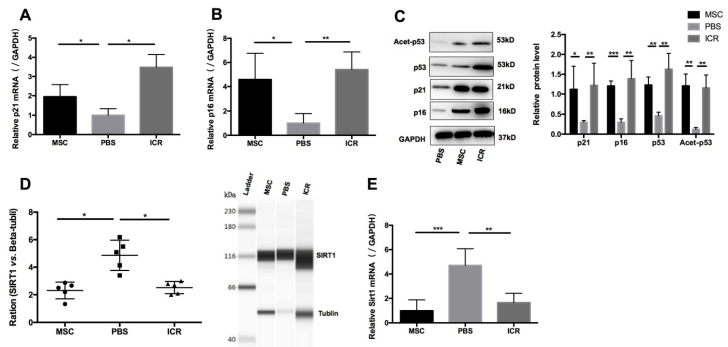
圖2 hUC-MSCs治療使MRL/lpr小鼠脾CD4+ T細胞的衰老標記物在體內(nèi)恢復正常
3、hUC-MSCs在體外增加MRL/lpr小鼠脾CD4+ T細胞的衰老通過Sirt1
在體內(nèi)實驗的同時,在體外測定了hUC-MSCs對T細胞衰老的影響。MRL/lpr小鼠脾CD4+ T細胞與hUC-MSCs以不同比例(CD4+ T細胞:MSCs: 1:1、10:1、50:1)共培養(yǎng)48 h。結(jié)果發(fā)現(xiàn)hUC-MSCs呈劑量依賴性方式顯著上調(diào)p21和p16的水平,但下調(diào)Sirt1的水平 (圖3A-C)。此外,細胞衰老的調(diào)節(jié)并不依賴于細胞與細胞之間的接觸,用transwell系統(tǒng)分離培養(yǎng)的CD4+ T細胞和MSCs時也發(fā)現(xiàn)了類似的結(jié)果(圖3D - F)。這些數(shù)據(jù)表明,可溶性因子介導了hUC-MSCs對MRL/lpr小鼠脾CD4+ T細胞衰老的調(diào)節(jié)作用。
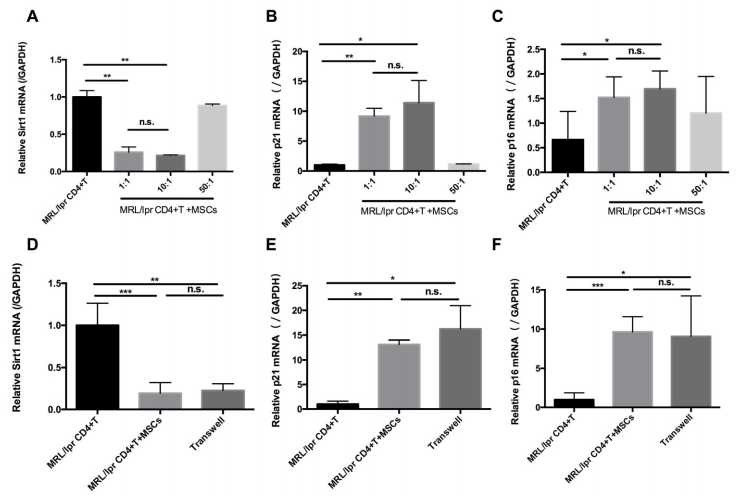
圖3 hUC-MSCs體外增加脾CD4+ T細胞衰老標志物
4、Sirt1是在MRL/lpr小鼠中hUC - MSCs介導的CD4+ T細胞衰老所必須的
接下來,檢測了Sirt1是否是hUC-MSCs促進MRL/lpr脾CD4+ T細胞衰老所足夠和必要的。研究發(fā)現(xiàn),使用Sirt1抑制劑- EX527預處理MRL/lpr小鼠的CD4+ T細胞后,Sirt1的表達減弱,p21和p16的表達和p53的乙酰化水平均增加了 (圖4A)。相反地,用Sirt1的選擇性激活劑SRT1720預處理MRL/lpr小鼠的CD4+ T細胞后,可以抑制hUC-MSCs誘導的衰老(圖4B)。綜上所述,這些數(shù)據(jù)表明Sirt1是hUC-MSCs增加MRL/lpr小鼠脾CD4+ T細胞衰老的關(guān)鍵介質(zhì)。
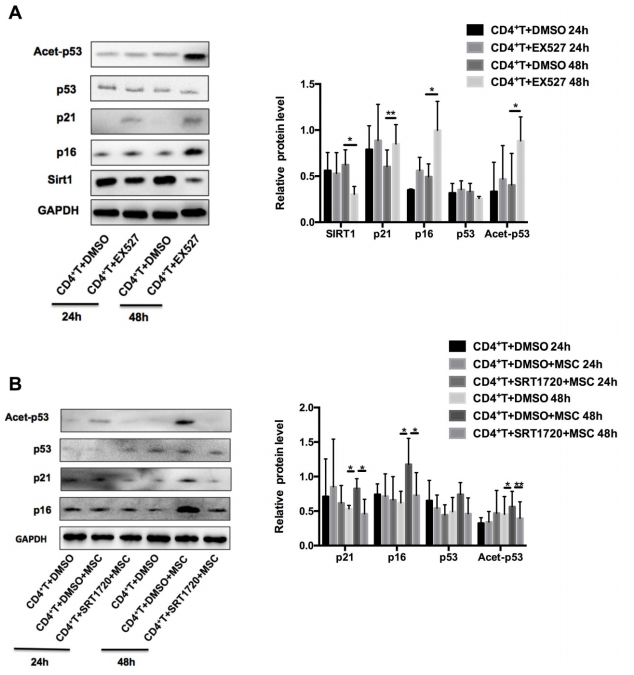
圖4 Sirt1是hUC-MSCs增加MRL/lpr小鼠脾CD4+ T細胞衰老的中介物
5、hUC-MSCs調(diào)節(jié)MRL/lpr小鼠脾CD4+T細胞Sirt1/p53信號通過miR-199a-5p
文獻報道在癌癥和自身免疫疾病中,hUC-MSCs能夠?qū)?/span>miRNAs轉(zhuǎn)移到周圍的細胞。因此,作者考慮miRNAs是否可能參與hUC - MSCs介導的對脾CD4+ T細胞中Sirt1的表達調(diào)控。使用在線軟件Target scan識別了10個miRNA,這些miRNA被預測靶向Sirt1。qPCR分析顯示,在這10個miRNAs中,只有miR-199a-5p的表達在MRL/lpr脾CD4+ T細胞中顯著降低(圖5A)。此外,miR-199a-5p是hUC-MSCs處理后唯一表達增加的miRNA(圖5A)。事實上,miR-199a-5p mimic不僅可以提高MRL/lpr脾CD4+ T細胞中miR-199a-5p的水平,降低Sirt1的表達(圖5B-C),而且還可以提高衰老標志物p21、p16和乙酰化p53的表達水平(圖5D)。相反,miR-199a-5p抑制劑處理可提高WT小鼠脾CD4+ T細胞中Sirt1的表達(圖5E),并降低衰老標志物p21, p16和乙酰p53水平(圖5F)。最后,與MRL/lpr相比,hUC-MSCs可增加miR-199a-5p的產(chǎn)生,表明hUC-MSCs是miR-199a-5p來源的關(guān)鍵調(diào)控因子 (圖5G)。在transwell系統(tǒng)中,hUC-MSCs與MRL/lpr脾CD4+ T細胞共培養(yǎng)48 h后,細胞內(nèi)miR-199a-5p升高,Sirt1基因表達降低,CD4+ T細胞中衰老標志物的表達水平恢復,而miR-199a-5p抑制劑處理后仍處于抑制狀態(tài)(圖5G-I)。總的來說,這些數(shù)據(jù)表明hUC-MSCs通過miR-199a-5p介導的Sirt1下調(diào)和隨后p53去乙酰化的減少,增加了脾臟CD4+ T細胞的衰老。
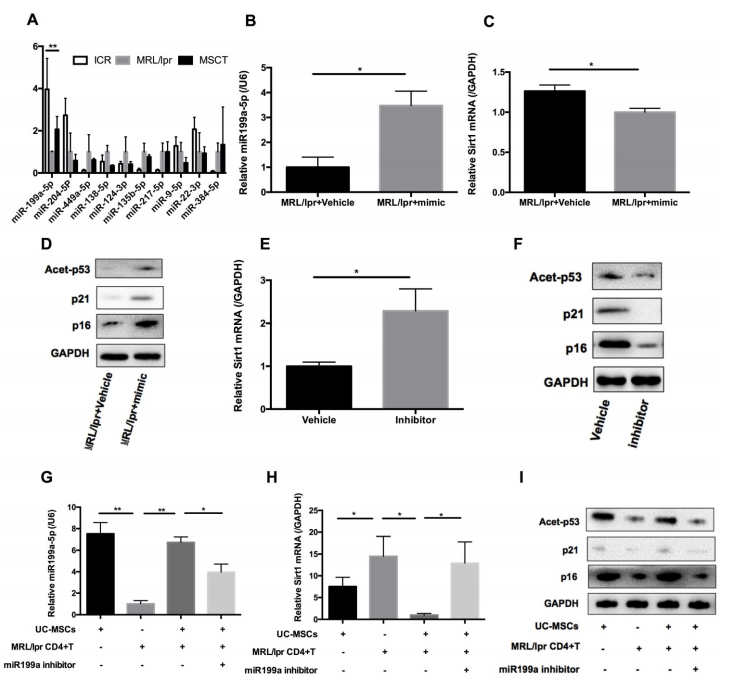
圖5 hUC-MSCs誘導的miR-199a-5p可增加MRL/lpr脾CD4+ T細胞衰老
6、MiR-199a-5p改善MRL/lpr小鼠疾病
接下來,在體內(nèi)評估了miR-199a-5p對MRL/lpr小鼠的影響。17周齡MRL/lpr小鼠每4天注射20 nmol miR-199a-5p agomir或?qū)φ?/span>(agomir nc),共4周(圖6A)。末次注射后48 h處死小鼠,分離脾臟CD4+ T細胞。與對照組相比,miR-199a-5p agomir處理組顯示miR-199a-5p水平升高(圖6B), Sirt1表達降低(圖6C),衰老標志物p21和p16的表達顯著上調(diào)(圖6D)。這些數(shù)據(jù)表明hUC-MSCs通過miR-199a-5p增加MRL/lpr脾CD4+ T細胞衰老。
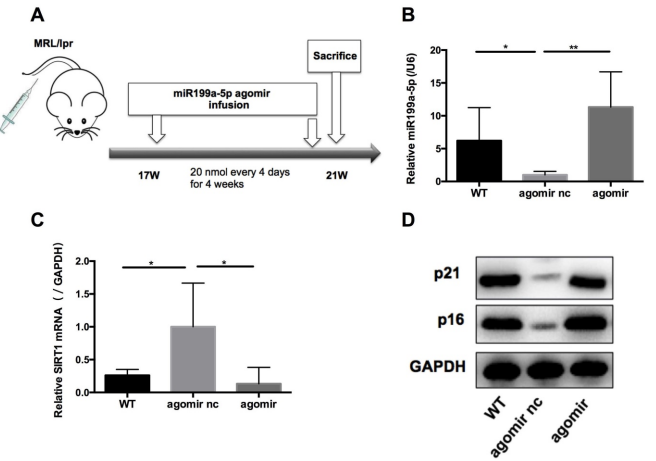
圖6 MiR-199a-5p agomir處理增加MRL/lpr脾CD4+ T細胞的衰老
接下來,研究系統(tǒng)給予miR-199a-5p agomir是否能挽救MRL/lpr小鼠的狼瘡表型。與agomir nc組相比,miR-199a-5p agomir處理組脾臟和淋巴結(jié)明顯縮小(圖7A-B),血清中anti-dsDNA抗體、IgG水平下降(圖7D-E)。血清ANA水平有下降趨勢(圖7C)。miR-199a-5p agomir處理組的腎損傷,表現(xiàn)為尿蛋白下降(圖7F),腎小球增大和細胞增生減少(圖7G),外周毛細血管袢中IgG沉積減少(圖7h)。綜上所述,這些數(shù)據(jù)表明hUC-MSCs移植通過miR -199a-5p介導的Sirt1信號下調(diào)從而增加脾CD4+ T細胞的衰老,改善MRL/lpr小鼠的疾病表型。
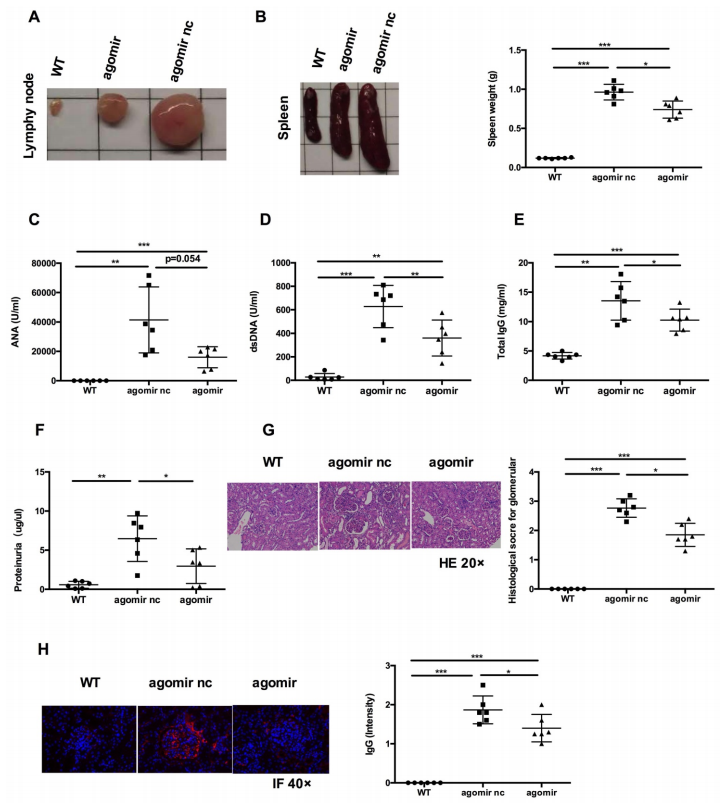
圖7 MiR-199a-5p agomir治療可改善MRL/lpr小鼠的疾病表型和免疫紊亂
參考文獻:
Cheng Tao., Ding Shuai., Liu Shanshan., Li Yan., Sun Lingyun.(2021). Human umbilical cord-derived mesenchymal stem cell therapy ameliorates lupus through increasing CD4+ T cell senescence via MiR-199a-5p/Sirt1/p53 axis. Theranostics, 11(2), 893-905. doi:10.7150/thno.48080






