間充質干細胞誘導的lncRNA 與腫瘤耐藥
導語:曲妥珠單抗耐藥已成為乳腺癌治療的主要障礙,間充質干細胞(MSCs)在耐藥性的形成過程中發(fā)揮關鍵作用,然而,其潛在機制尚不清楚。長鏈非編碼RNAs(lncRNAs)參與腫瘤進展,參與調節(jié)曲妥珠單抗耐藥性。MSCs與lncRNAs產(chǎn)生哪些調控效應,這里告訴你。
參考文獻:IF=7.971

技術路線:

結果:
1. MSC引起乳腺癌(BC)細胞干性和曲妥珠單抗耐藥
為分析MSCs對干性和曲妥珠單抗耐藥的影響,將SKBR-3和BT474兩種HER-2 + BC細胞系與MSCs共培養(yǎng),發(fā)現(xiàn)細胞的球形形成能力顯著提高,干性基因均顯著上調,CD4陽性細胞的比例增加。CCK8檢測結果顯示骨髓間充質干細胞培養(yǎng)降低了曲妥珠單抗介導的細胞毒性,表明骨髓間充質干細胞在體外誘導曲妥珠單抗耐藥。
在異種移植模型中證實MSC的作用。將SKBR-3細胞注射到裸鼠體內,或與骨髓間充質干細胞混合注射,各組腹腔內給予曲妥珠單抗治療。結果發(fā)現(xiàn)SKBR-3細胞單獨作用未能生成異種移植物,然而,與骨髓間充質干細胞的細胞混合物成功建立了異種移植物,增加了SKBR-3細胞移植的腫瘤重量。IHC檢測曲妥珠單抗耐藥組織和BC患者曲妥珠單抗應答組織中MSC表面抗原CD29和CD90的表達,發(fā)現(xiàn)耐藥組CD29 +/CD90 + 患者的比例顯著增高,較高的CD29 +/CD90 + 組織與臨床分期呈正相關。以上結果提示骨髓間充質干細胞共培養(yǎng)可誘導干性和曲妥珠單抗耐藥。
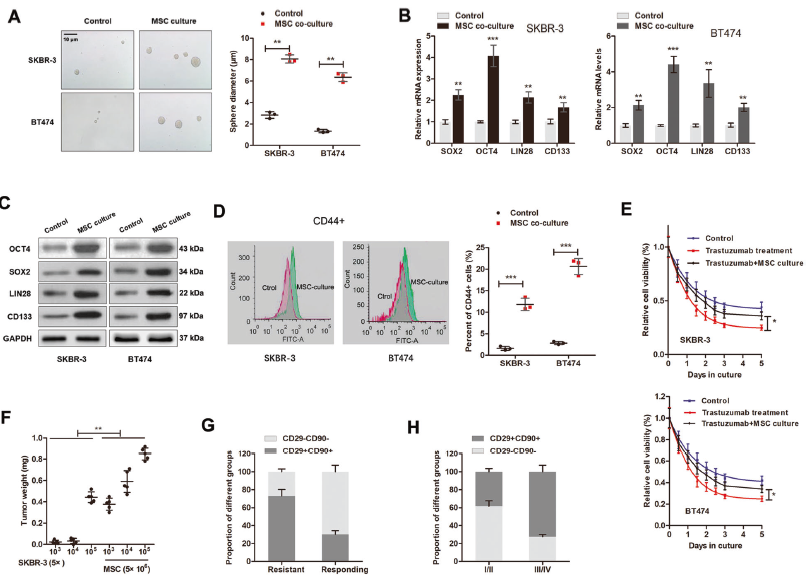
2. MSC誘導的lncRNA AGAP2-AS1介導干性和曲妥珠單抗耐藥
為鑒定AGAP2-AS1是否由骨髓間充質干細胞誘導,檢測其在與骨髓間充質干細胞共培養(yǎng)的SKBR-3和BT474細胞中的表達,發(fā)現(xiàn)與MSCs共培養(yǎng)的細胞中AGAP2-AS1顯著上調。AGAP2-AS1在CD29 + CD90 + 患者BC組織中上調。研究AGAP2-AS1對干性的影響,過表達AGAP2-AS1后BC細胞中AGAP2-AS1和干性基因上調,CD44 + BC細胞比例增加,誘導BC細胞球體形成和曲妥珠單抗耐藥。沉默AGAP2-AS1效果相反。這些表明MSC通過誘導AGAP2-AS1引起干性和曲妥珠單抗耐藥。
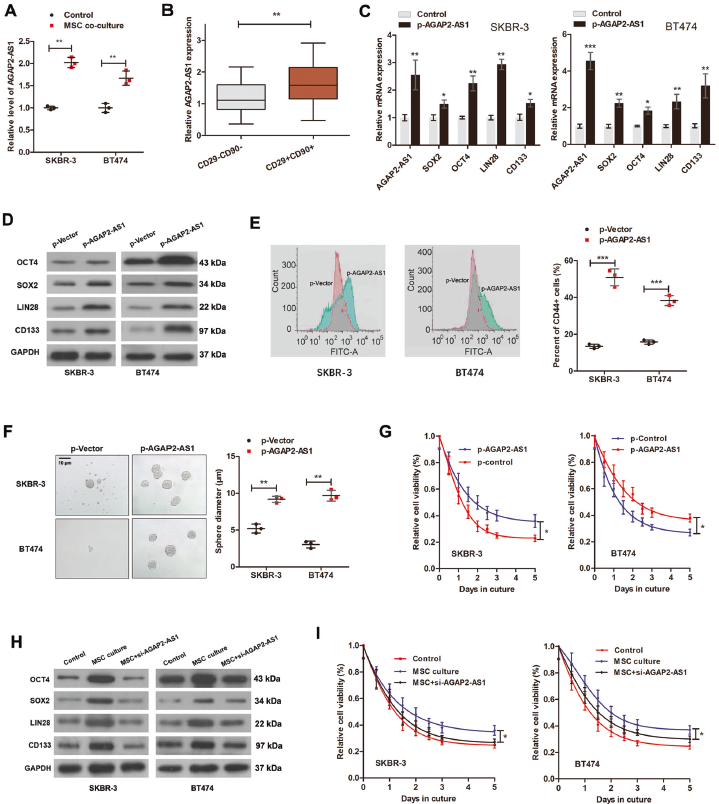
3. AGAP2-AS1對干性和曲妥珠單抗耐藥性的作用依賴于FAO
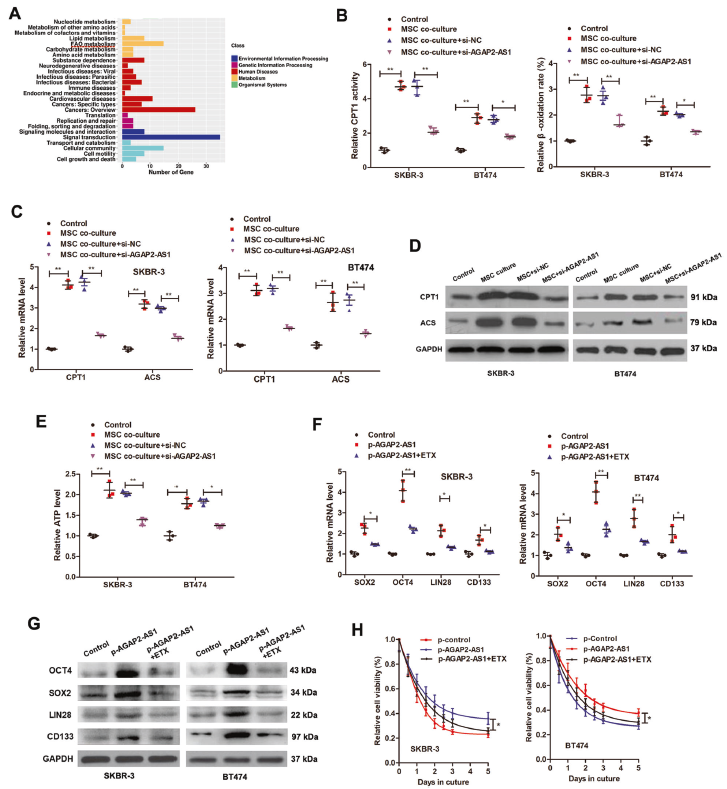
使用starBase3.0獲得AGAP2-AS1的靶基因,并通過DAVID6.8進行KEGG通路分析。發(fā)現(xiàn)AGAP2-AS1靶基因在代謝中顯著富集,如FAO代謝。MSC共培養(yǎng)誘導了CPT1的活性和β-氧化率的增強,這種效應被敲除AGAP2-AS1所抵消。AGAP2-AS1的沉默也可逆轉MSC引起的CPT1、乙酰輔酶A合成酶(ACS)和ATP水平的上調。為證實FAO對于MSC-AGAP2-AS1誘導的干性和曲妥珠單抗耐藥性至關重要,使用FAO抑制劑依托莫西韋,發(fā)現(xiàn)抑制FAO可逆轉AGAP2-as1誘導的干性基因,可消除AGAP2-AS1誘導的曲妥珠單抗耐藥。表明MSC通過AGAP2-as1介導FAO誘導干性和曲妥珠單抗耐藥。
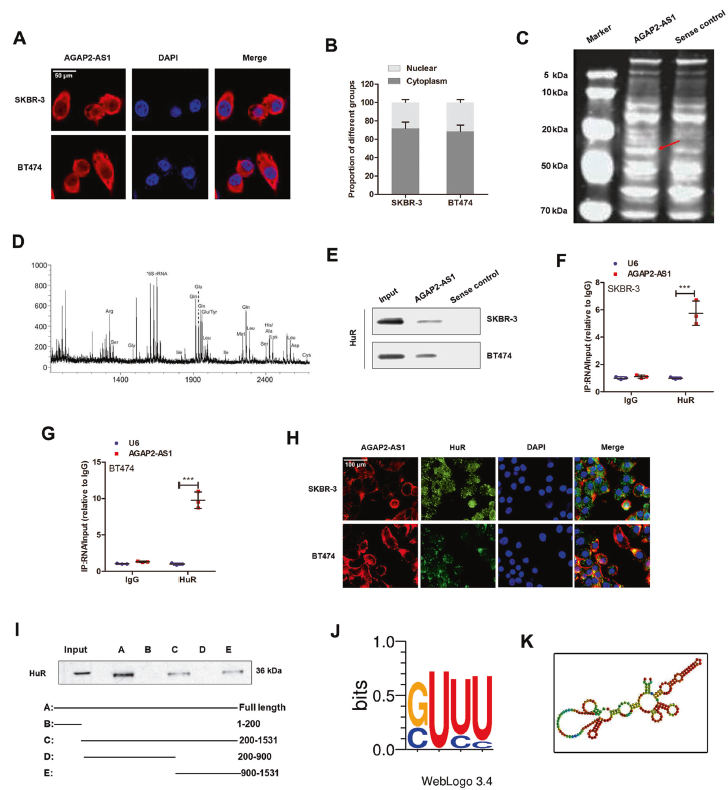
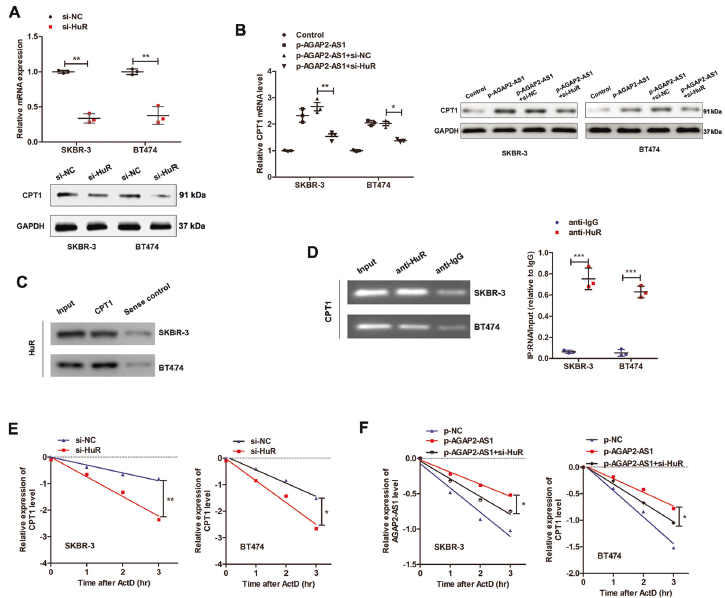
4. AGAP2-AS1與HuR相互作用
進一步探索AGAP2AS1的調控機制,利用RNA FISH和細胞核-細胞質分離qPCR鑒定亞細胞位置。結果提示,AGAP2-AS1位于細胞質。使用生物素化的AGAP2-AS1進行了RNA pull down實驗,質譜分析和western blotting鑒定出AGAP2-AS1的RNA結合蛋白-ELAV家族成員HuR。RIP試驗進一步證實AGAP2-AS1和HuR之間的直接相互作用RNA-FISH驗證AGAP2-AS1和HuR共定位在SKBR-3細胞的細胞質中,系列缺失分析發(fā)現(xiàn)AGAP2-AS1的900-1531nt區(qū)域對與HuR結合至關重要。POSTAR2預測在AGAP2-AS1的937-957nt區(qū)域顯示HuR的結合基序。而且,敲除HuR可消除干性和曲妥珠單抗耐藥性。上述結果證實AGAP2-AS1可能通過與HuR蛋白相互作用,在干性和曲妥珠單抗耐藥中發(fā)揮重要作用。
5. AGAP2-AS1-HuR復合物促進CPT1的穩(wěn)定性
由于CPT1在AGAP2-AS1調節(jié)的FAO過程中上調,假設CPT1可能是AGAP2-AS1–HuR復合物的直接靶點。MSCs共培養(yǎng)誘導CPT1的上調,當AGAP2-AS1在骨髓間充質干細胞中沉默時,這種上調被廢除,證明MSC來源的AGAP2-AS1誘導CPT1上調。敲低HuR可顯著抑制CPT1表達,并在轉錄和蛋白水平均可消除AGAP2-AS1誘導的CPT1表達。通過CPT1 RNA探針進行RNA pull down,驗證HuR和CPT1之間的直接相互作用,HuR抗體進行RIP分析進一步驗證。
使用放線菌素D阻斷RNA轉錄時, HuR沉默細胞中CPT1 RNA的穩(wěn)定性被顯著抑制。過表達AGAP2-AS1增加CPT1 mRNA的穩(wěn)定性,HuR沉默顯著逆轉此類效應,表明HuR對于AGAP2-AS1誘導的CPT1 mRNA穩(wěn)定性至關重要。以上結果表明AGAP2-AS1–HuR直接結合CPT1 mRNA并維持其穩(wěn)定性。
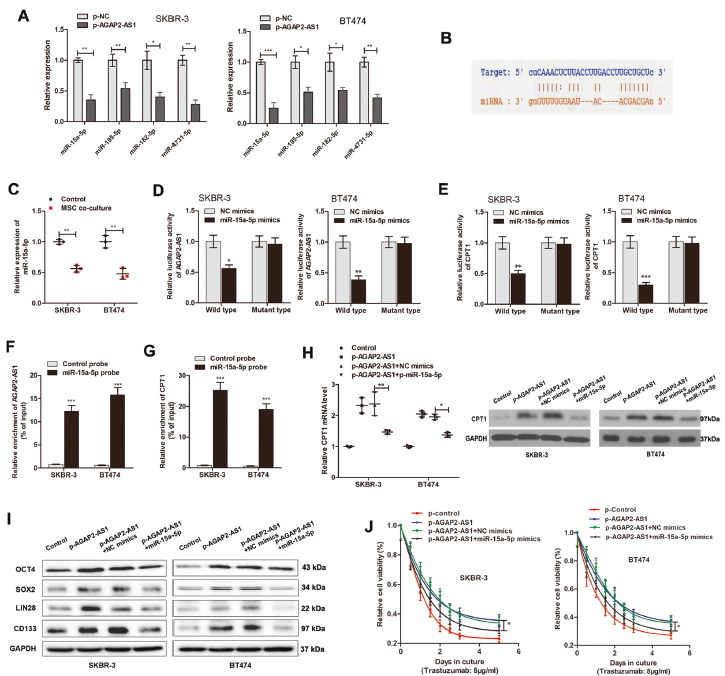
6. AGAP2-AS1海綿miR-15a-5p釋放CPT1
HuR部分逆轉AGAP2-AS1誘導的效應,假設AGAP2-AS1可能存在其他調節(jié)途徑,如作為競爭性內源性RNA。在線預測軟件鑒定AGAP2-AS1靶向的miRNA,qPCR驗證4個miRNA在AGAP2-AS1過表達BC細胞中下調,發(fā)現(xiàn)CPT1被預測為評分較高的miR-15a-5p的靶點。雙熒光素酶報告基因檢測顯示,miR-15a-5p可顯著抑制AGAP2-AS1和CPT1的熒光素酶活性,pull down試驗證實了AGAP2-AS2與miR-15a-5p、miR-15a-5p和CPT1之間的直接相互作用。miR-15a-5p模擬物顯著抑制干性,增加曲妥珠單抗介導的細胞毒性,逆轉AGAP2-AS1引起的CPT1水平升高。共表達miR15a-5p可消除AGAP2-AS1誘導的干性蛋白和曲妥珠單抗耐藥性。以上結果證明AGAP2-AS1/miR-15a-5p/CPT1調節(jié)軸在干性和曲妥珠單抗耐藥中的重要作用。
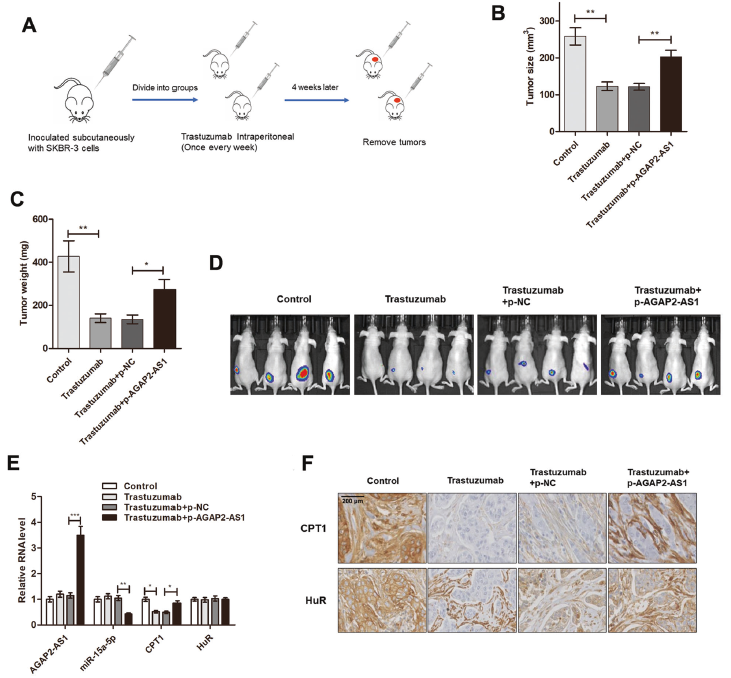
7. AGAP2-AS1促進體內干性和曲妥珠單抗耐藥性
為證實AGAP2-AS1在干性和曲妥珠單抗耐藥性中的重要作用,在BALB/c裸鼠中建立了異種移植瘤模型。將轉染pcDNA-AGAP2-AS1的SKBR-3細胞與骨髓間充質干細胞混合后接種于小鼠皮下,小鼠接受曲妥珠單抗治療。發(fā)現(xiàn)曲妥珠單抗治療顯著抑制了腫瘤生長,然而,當細胞與AGAP2-AS1過表達時,這種效應被急劇逆轉,過表達AGAP2-AS1的SKBR-3細胞生成的腫瘤表現(xiàn)出較高的AGAP2AS1和較低的miR-15a-5p表達。曲妥珠單抗在異種移植物中減少的CPT1的表達可通過AGAP2-AS1過表達來挽救。IHC分析顯示,在過表達AGAP2-AS1的異種移植物中,CPT1染色較高,而AGAP2-AS1未改變HuR染色。表明AGAP2-AS通過靶向體內CPT1介導干性和曲妥珠單抗耐藥性。
8. AGAP2-AS1預測BC患者對曲妥珠單抗的治療反應
分析接受曲妥珠單抗治療的患者血清樣本,發(fā)現(xiàn)無應答患者中AGAP2-AS1上調。受試者工作特征(ROC)曲線顯示AGAP2-AS1在區(qū)分有反應和無反應患者方面具有相對較高的預測價值,ROC曲線將患者分為AGAP2-AS1高表達或低表達組,AGAP2-AS1高表達組對曲妥珠單抗治療表現(xiàn)出反應的患者百分比遠低于AGAP2AS1低表達組。







