KRAS介導(dǎo)自噬依賴(lài)性鐵死亡驅(qū)動(dòng)腫瘤相關(guān)巨噬細(xì)胞的極化
研究背景:
KRAS是人體腫瘤中最常見(jiàn)的突變癌基因。盡管很多研究報(bào)道了KRAS突變對(duì)癌細(xì)胞的影響,但是致癌KRAS的激活對(duì)免疫細(xì)胞的直接影響仍不清楚。文章研究細(xì)胞外KRASG12D作為癌細(xì)胞-巨噬細(xì)胞間通信的關(guān)鍵中介(IF= 9.77)。
技術(shù)路線圖:

研究結(jié)果:
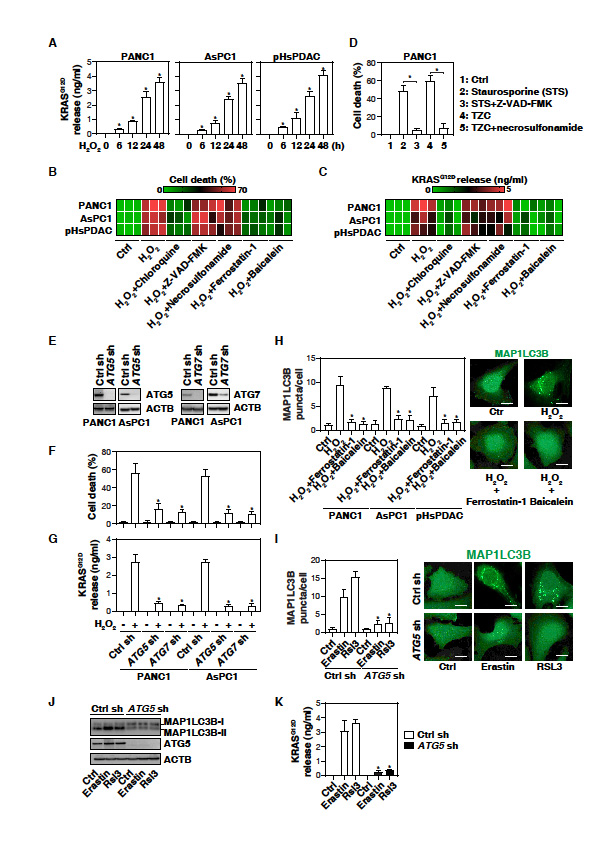
1. 在自噬依賴(lài)性鐵下垂癌細(xì)胞死亡中,KRASG12D在胞外釋放
胰腺導(dǎo)管腺癌(PDAC)的發(fā)生和發(fā)展與氧化應(yīng)激有關(guān)。在人PDAC細(xì)胞系(PANC1和AsPC1,都發(fā)生KRASG12D突變)確定氧化應(yīng)激是否會(huì)誘導(dǎo)癌蛋白的釋放。H2O2以時(shí)間依賴(lài)性的方式誘導(dǎo)NC1和AsPC1細(xì)胞以及人初級(jí)PDAC細(xì)胞(pHsPDAC)釋放KRASG12D (圖1A)。提示氧化應(yīng)激引起PDAC細(xì)胞釋放KRASG12D。H2O2可以觸發(fā)多種形式的調(diào)控細(xì)胞死亡,比如細(xì)胞凋亡,壞死和自噬依賴(lài)的細(xì)胞死亡。H2O2誘導(dǎo)的細(xì)胞死亡(圖1B)和PDAC細(xì)胞釋放KRASG12D(圖1C)被自噬抑制劑阻斷(chloroquine),但是凋亡抑制劑或壞死凋亡抑制劑(Z-VAD-FMK和necrosulfonamide)沒(méi)有這種作用。敲除自噬相關(guān)基因限制了H2O2誘導(dǎo)的細(xì)胞死亡和KRASG12D的釋放(圖1E-1G),進(jìn)一步證實(shí)自噬依賴(lài)性細(xì)胞死亡促進(jìn)氧化應(yīng)激期間KRASG12D蛋白釋放。
鐵死亡抑制劑(ferrostatin-1和baicalein)阻斷H2O2誘導(dǎo)的MAP1LC3B的斑點(diǎn)形成(圖1H),抑制PDAC細(xì)胞死亡(圖1B)和KRASG12D釋放(圖1C)。Erastin和RSL3等鐵死亡誘導(dǎo)劑也能誘導(dǎo)MAP1LC3B斑點(diǎn)(圖1I)、MAP1LC3B脂化(產(chǎn)生MAP1LC3B II)和KRASG12D釋放(圖1K)。敲除ATG5逆轉(zhuǎn)這些效應(yīng)(圖1I - 1k)。結(jié)果提示鐵死亡可導(dǎo)致PDAC細(xì)胞中KRASG12D蛋白的釋放。
Figure1
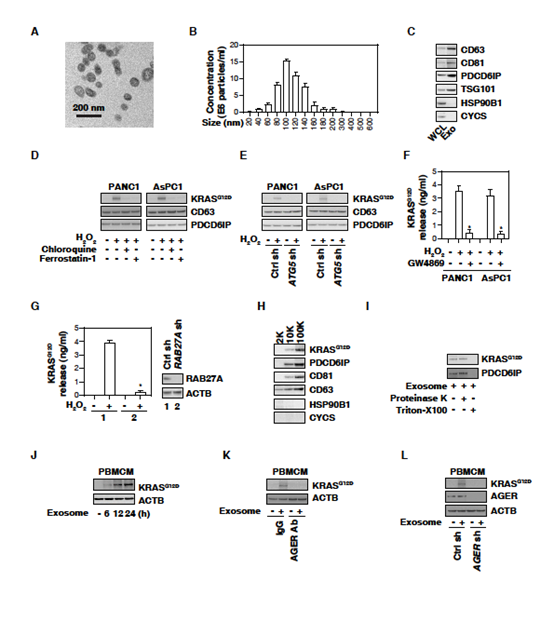
2. 巨噬細(xì)胞外泌體攝取KRASSG12D需要AGER
之后研究了KRASG12D蛋白是否存在于外泌體中。電子顯微鏡、納米顆粒分析和WB檢測(cè)外泌體分離方法的純度。囊泡大小50-150nm (圖2A、2B),WB檢測(cè)CD63、CD81、PDCD6IP/ALIX、TSG101、HSP90B1 / GRP94和CYCS (圖2C)進(jìn)一步證明。在PANC1和AsPC1細(xì)胞分離的外泌體中,H2O2刺激導(dǎo)致KRASG12D蛋白(不影響CD63和PDCD6IP/ALIX)的增加;氯喹和ferrostatin-1阻斷了KRASG12D蛋白的積累(圖2D);敲除自噬相關(guān)基因ATG5或應(yīng)用GW4869(外泌體生成和釋放的抑制劑)抑制了H2O2誘導(dǎo)的KRASG12D蛋白的積累(圖2E,F(xiàn))。外泌體分泌的關(guān)鍵調(diào)節(jié)因子RAB27A的敲除也抑制了H2O2誘導(dǎo)的PANC1細(xì)胞釋放KRASG12D (圖2G)。KRASG12D和PDCD6IP/ALIX均對(duì)蛋白酶K不敏感,但被Triton X-100降解(圖2I)。這些發(fā)現(xiàn)表明自噬依賴(lài)的鐵死亡導(dǎo)致KRASG12D從外泌體釋放。
之后研究腫瘤來(lái)源外泌體中的KRASG12D蛋白是否能被巨噬細(xì)胞吸收。人外周血單核細(xì)胞來(lái)源巨噬細(xì)胞(PBMCMs)通常不含KRASG12D,但以時(shí)間依賴(lài)性的方式吸收H2O2產(chǎn)生的癌癥外泌體(圖2J),提示腫瘤KRASG12D可進(jìn)入巨噬細(xì)胞。AGER抗體抑制H2O2生成的癌癥外泌體培養(yǎng)的PBMCMs對(duì)KRASG12D的攝取(圖2K)。類(lèi)似地,在PBMCMs中,敲除AGER損害了KRASG12D從腫瘤來(lái)源外泌體的攝取(圖2L)。結(jié)果表明,AGER介導(dǎo)巨噬細(xì)胞攝取KRASG12D
Figure2
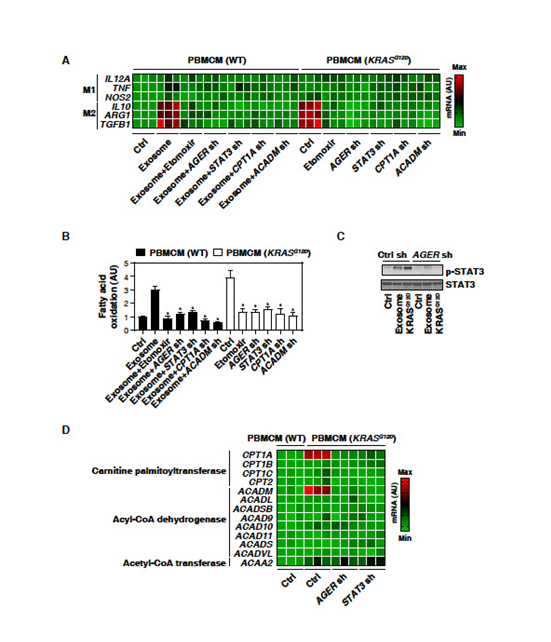
3. KRASG12D通過(guò)STAT3依賴(lài)性脂肪酸氧化促進(jìn)巨噬細(xì)胞M2極化
巨噬細(xì)胞攝取KRASG12D可能影響巨噬細(xì)胞極化。敲除PBMCMs中KRASG12D,并檢測(cè)M1分化(IL-12A、TNF和NOS2/iNOS)或M2極化(IL-10、ARG1和TGFB1)的生物標(biāo)志物。
表達(dá)KRASG12D的PBMCMs中IL-10、ARG1和TGFB1 mRNA(M2極化)表達(dá)上調(diào)(M1極化不變);H2O2產(chǎn)生的癌癥外泌體也增加了PBMCMs產(chǎn)生的M2 mRNA表達(dá), AGER敲除所逆轉(zhuǎn)(圖3A)。因此,KRASG12D的攝取可能導(dǎo)致促癌的M2極化。脂肪酸氧化的情況類(lèi)似(圖3B)。脂肪酸氧化抑制劑Etomoxir降低了KRASG12D表達(dá)或PDAC細(xì)胞來(lái)源的外泌體的PBMCMs中IL10、ARG1和TGFB1 mRNA表達(dá)(圖3A)。因此,脂肪酸氧化有助于KRASG12D介導(dǎo)的M2巨噬細(xì)胞極化。
為了解KRASG12D驅(qū)動(dòng)的巨噬細(xì)胞中脂肪酸氧化加劇的機(jī)制,文章重點(diǎn)研究了STAT3。 WB分析發(fā)現(xiàn)在表達(dá)KRASG12D或腫瘤外泌體處理的PBMCMs中,STAT3的磷酸化水平上調(diào)(圖3C)。與AGER的敲除類(lèi)似,在KRASG12D或H2O2誘導(dǎo)的癌癥外泌體的PBMCMs中,敲除STAT3減少脂肪酸氧化(圖3B)和M2巨噬細(xì)胞極化(圖3A)。因此,AGER介導(dǎo)的STAT3的活化需要KRASG12D-誘導(dǎo)脂肪酸氧化和巨噬細(xì)胞極化。
之后,確定參與脂肪酸氧化代謝途徑的基因是否會(huì)被AGER介導(dǎo)的STAT3激活所調(diào)控。在表達(dá)KRASG12D的PBMCMs中,其他脂肪酸氧化相關(guān)基因(如CPT1B, CPT1C, CPT2, ACADL, ACADSB, ACAD9, ACAD10, ACAD11,ACADS,ACADVL,和ACAA2)上調(diào) (圖3 D)。這一效應(yīng)被敲除AGER或STAT3抑制(圖3D)。在KRASG12D表達(dá)或?qū)Π┌Y外泌體應(yīng)答的PBMCMs中,敲除CPT1A和ACADM抑制脂肪酸氧化(圖3B)和IL10、ARG1和TGFB1 mRNA表達(dá)(圖3A)。結(jié)果表明AGER-STAT3通路對(duì)于KRASG12D誘導(dǎo)的脂肪酸氧化和隨后的巨噬細(xì)胞M2極化至關(guān)重要。
Figure3
4. 體內(nèi)阻斷KRASG12D的釋放和攝取抑制巨噬細(xì)胞介導(dǎo)的胰腺腫瘤生長(zhǎng)
探索KRASG12D蛋白從癌細(xì)胞向巨噬細(xì)胞的可能路徑。在NOD SCID小鼠背側(cè)皮下注射PANC1細(xì)胞或PANC1細(xì)胞+PBMCMs。與單用PANC1細(xì)胞相比,PBMCMs促進(jìn)了胰腺腫瘤的生長(zhǎng)(圖4A)。局部注射氯喹、ferrostatin-1或抗AGER抗體可抑制PANC1+PBMCMs引起的腫瘤的生長(zhǎng) (圖4)。AGER的敲除(圖4B)降低了由PANC1細(xì)胞+PBMCMs引起的腫瘤生長(zhǎng)。此外,KRASG12D驅(qū)動(dòng)的PBMCMs比野生型PBMCMs更能促進(jìn)胰腺腫瘤的生長(zhǎng)(圖4C)。當(dāng)STAT3、ATG5、CPT1A或RAB27A敲除時(shí),PBMCMs表達(dá)KRASG12D的腫瘤加速作用消失(圖4C)。這些發(fā)現(xiàn)表明,KRASG12D或KRASG12D轉(zhuǎn)入PBMCMs可通過(guò)ATG5、STAT3、CPT1A和RAB27A等通路驅(qū)動(dòng)PDAC的進(jìn)展。
Figure4

5. 巨噬細(xì)胞中KRASG12D的高表達(dá)與PDAC患者較差的生存相關(guān)
為了確定在人類(lèi)胰腺癌中KRASG12D在巨噬細(xì)胞表達(dá)異常,分析59個(gè)PDAC病人(表1)。在CD68+巨噬細(xì)胞中檢測(cè)出KRASG12D表達(dá)(圖5A)。PDAC病人CD68+巨噬細(xì)胞中有高KRASG12D顯示短生存期,比病人含有低KRASG12D在腫瘤浸潤(rùn)性CD68 +巨噬細(xì)胞 (圖5B)。這些發(fā)現(xiàn)表明巨噬細(xì)胞攝取KRASG12D的增加可能促進(jìn)了人PDAC的進(jìn)展。
Figure5







