一箭雙雕的CircITCH:抑制癌癥 減輕阿霉素的心臟毒性
阿霉素(DOX)是目前最有效的抗腫瘤藥物之一,但是因為它有嚴重心臟毒性風險,所以其臨床應用受到限制。前人的研究已經確定CircITCH是一種廣譜的腫瘤抑制環狀RNA,其宿主基因ITCH參與了doxbicin誘導的心臟毒性(DOXIC)。CircITCH是否在DOXIC中起作用還不清楚。本文為解決這一問題提供了部分答案,并于2020年5月11日發表于《Circulation Research》IF:14.467期刊上。
技術路線如下:
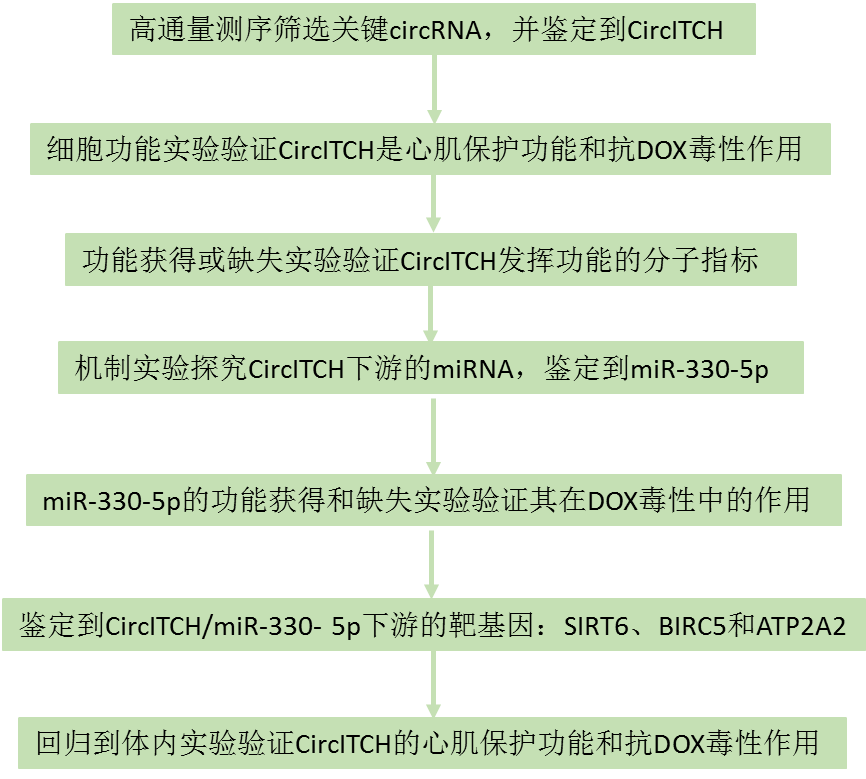
本文結果如下:
1、CircRNA在人類DOXIC處理和健康心臟組織中的表達模式
為了篩選潛在的候選circRNA,對3例DOX誘導的心肌病人組織和3里非疾病健康捐贈者的心臟組織進行circRNA表達譜測序。如圖1A所示,獲得了19112個circRNAs,其中84.93來自與外顯子基因組。另外,在兩組間差異表達的circRNA有356個,207個在病人中上調,149個下調(Fig. 1B)。對最顯著上調的差異circRNA進行PCR數據庫驗證,發現hsa_circ_0001141,其宿主基因ITCH下調并參與DOXIC,因此,作者初步選定ITCH來源的circRNA。
對5個ITCH來源的circRNAs亞型的驗證表明hsa_circ_0001141是僅有的一個富集趨勢符合預期的亞型,將其命名為CircITCH。隨后驗證了其首尾相接的環形結構和大小(Fig. 1C-F)。亞細胞定位顯示CircITCH主要分布于細胞質,暗示可能吸附miRNA發揮作用。隨后,實驗發現DOX處理后CircITCH的表達顯著下降(Fig. 1I-K)。這些數據暗示CircITCH在DOXIC中發揮作用。
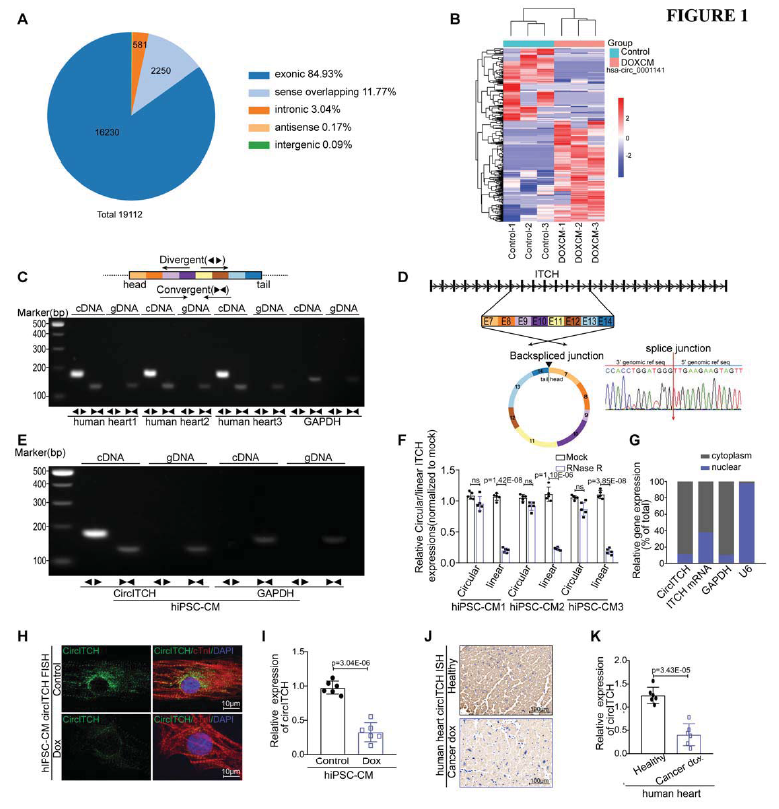
圖1 CircITCH表達模式在DOXIC在人類樣本
2、CircITCH過表達減輕了DOX誘導的細胞死亡,收縮功能障礙和鈣處理缺陷
隨后作者探究了CircITCH在DOX誘導的hiPSC-CMs損傷和功能異常中的作用。為此,使用三種正常的iPSC細胞系和五批基于單分子層的心肌分化方案來生成hiPSC-CM。在hiPSC-CM分化后的30-35天使用CircITCH表達的腺病毒轉導至葡萄糖饑餓純化的hiPSC-CM中,并檢測到CircITCH的高表達,而ITCH的表達無變化。同時使用CircITCH-ir沒有下游反向序列做對照。將上述構建的細胞暴露于DOX,檢測到CircITCH在hiPSC-CMs中過表達可以防止細胞活性喪失(Fig. 2A-D)。CircITCH過表達也能抑制乳酸脫氫酶(LDH)滲漏、心肌細胞壞死指數和EthD1陽性死亡細胞數(Fig. 2B, E-F)。
DOX處理后在hiPSC-CMs細胞中觀察到單層的收縮/松弛速度和變形距離顯著下降,而CircITCH過表達能顯著阻止上述趨勢,并且DOX處理的hiPSC-CMs細胞的收縮特性都得到明顯改善(Fig. 2G-I)。此外,作者在單細胞水平進行了鈣離子成像檢測,與上述結果一致,DOX可降低hiPSC-CMs的鈣波幅并引起舒張期鈣超載,相反的,CircITCH過表達緩和上述改變(Fig. 2J-L)。這些結果證明CircITCH過表達保護免受DOX誘導的hiPSC-CMs細胞損傷和功能異常。
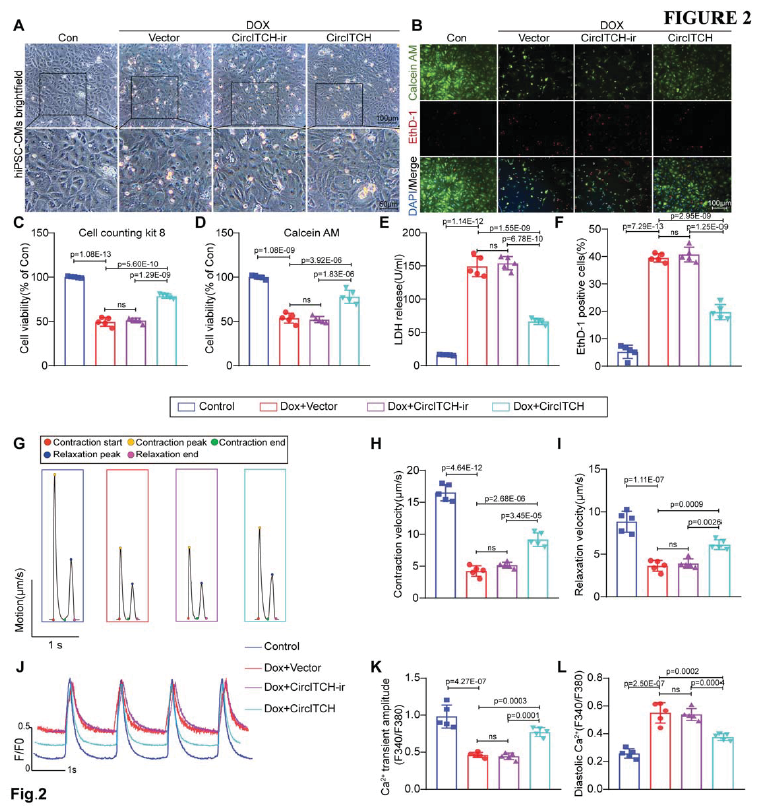
圖2 CircITCH減輕了DOXIC在hiPSC-CMs的作用和改善其功能
3、CircITCH過表達可緩解DOX對hiPSC-CMs細胞/線粒體的氧化應激和DNA損傷
為了探究CircITCH引起的心肌保護機制,接下來評估hiPSC-CMs細胞的氧化應激和DNA損傷水平,這是DOXIC相關的兩個主要的指標。與此前的報道一致,DOX處理引發DNA雙鏈斷裂(DSB),導致γ-H2AX陽性細胞的比例增加(Fig. 3A, C, D),該結果可通過ATM磷酸化增加證實(Fig. 3 B, E, F)。另一個DNA損傷的指標,8-OHdG泄露,其結果與上述一致(Fig. 3J)。此外,CircITCH過表達可以減緩線粒體DNA損傷(Fig. 3I)。類似的,DOX處理增加了線粒體和細胞的氧化應激,但CircITCH過表達可以部分消除這種反應(Fig. 3 G, H, K)。
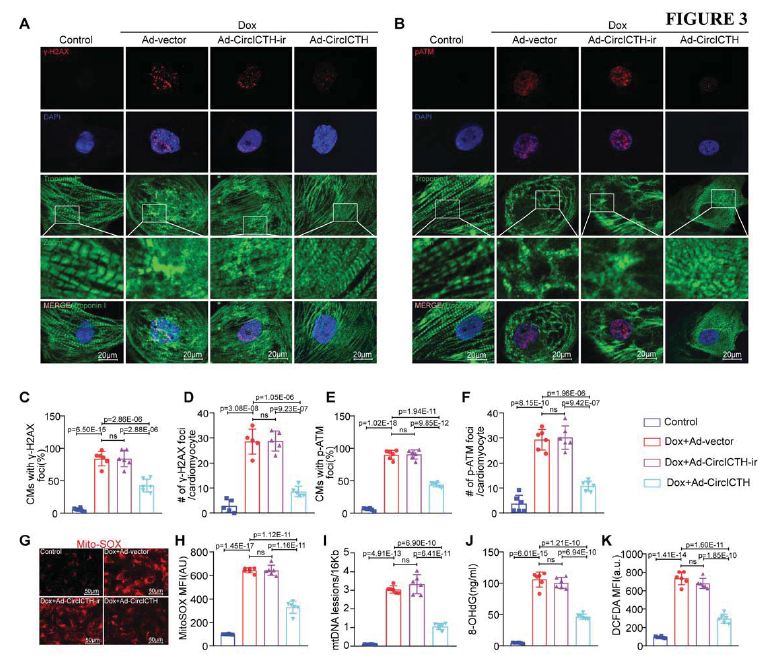
圖3 CircITCH可緩解DOX對hiPSC-CMs細胞/線粒體的氧化應激和DNA損傷
4、CircITCH保護免受DOXIC通過miR-330-5p
通過對RegRNA 2.0和CircInteractome的預測結果進行重疊獲得了8個CircITCH潛在的靶向miRNA (Fig. 4A)。生物素標記的CircITCH探針pull-down實驗,檢測到miR-330-5p, miR-214-3p, miR-7-5p, 和miR-1296的顯著富集(Fig. 4B-E)。熒光素酶實驗發現miR-330-5p最能顯著改變熒光素酶活性。此外,生物素偶聯miR-330-5p比生物素偶聯突變體探針捕獲更多CircITCH (Fig. 4 F, G),FISH顯示CircITCH和miR330-5p存在共定位(Fig. 4H)。這些結果驗證了miR330-5p可以在hiPSC-CMs中與CircITCH結合。
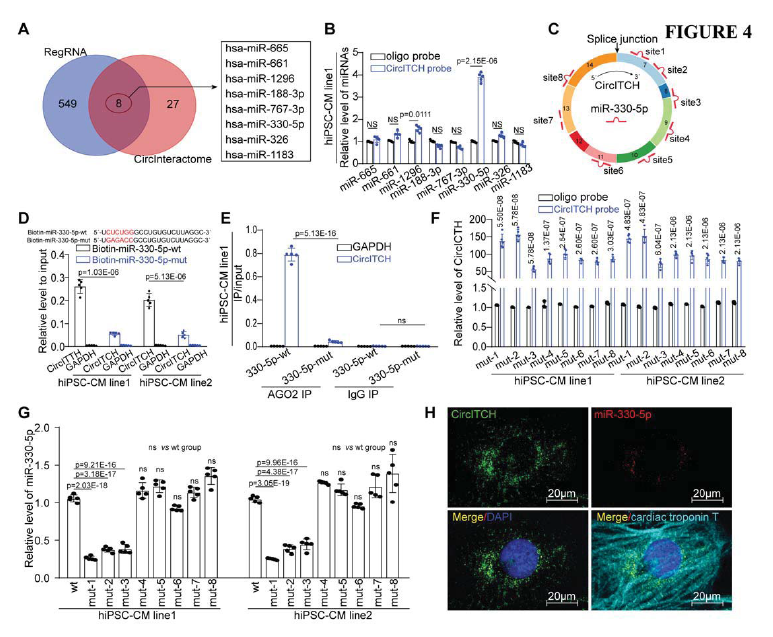
圖4 CircITCH在hiPSC-CMs中起著內源性miR-330-5p海綿的作用
5、MiR-330-5p在dox處理的hiPSC-CMs中上調,其沉默可防止DOXIC
如圖Fig. 5A所示,DOX處理后miR-330-5p的表達顯著上調。因此,隨后進行了miR-330-5p的抑制實驗,結果表明,抑制miR-330-5p后細胞活力增強,細胞死亡減少,LDH泄露降低,改善hiPSC-CMs的收縮和舒張速度,提高鈣波幅,降低舒張期鈣超載,減弱細胞和線粒體DNA損傷,抑制細胞和線粒體氧化應激,其效果與CircITCH過表達一致(Fig. 5B-M)。這些結果表明抑制miR-330-5p可以顯著抑制hiPSC-CMs中的DOXIC。
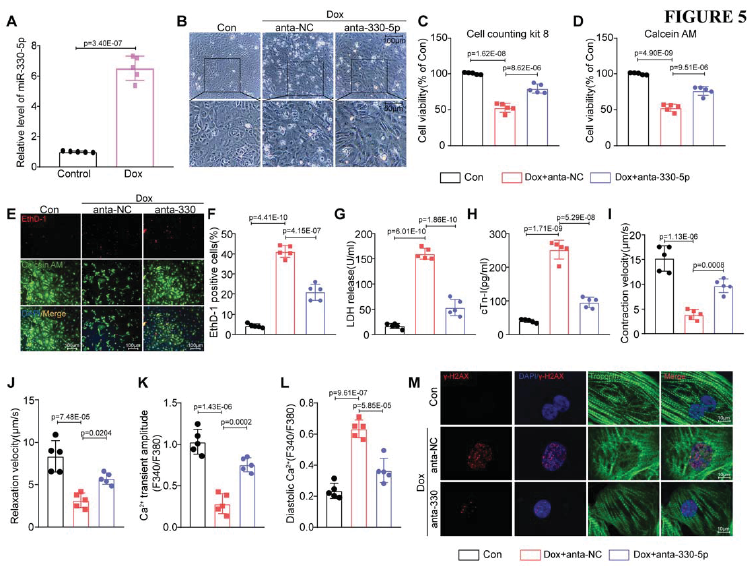
圖5 MiR-330-5p在dox處理的hiPSC-CMs中上調,其沉默可防止DOXIC
6、在DOX暴露的hiPSC-CMs細胞中,SIRT6、BIRC5和ATP2A2直接靶向miR-330-5p,并受到CircITCH/miR-330- 5p軸調控
如圖6A所示,GSE數據庫GSE79413, GSE64476, 和GSE97642這三個數據庫重疊的組合識別出84個miR-330- 5p的候選靶標。隨后通過PCR芯片,鑒定miR-330- 5p下調靶基因和DOX處理下調靶基因的重合基因,得到三個候選目標分子SIRT6、BIRC5和ATP2A2,隨后進行熒光素酶報告基因驗證,發現miR-330- 5p可以有效降低上述三個報告載體的熒光活性,而結合位點突變后熒光素酶活性沒有顯著改變,證明三個分子與miR-330- 5p具有結合作用(Fig. 6C-E)。
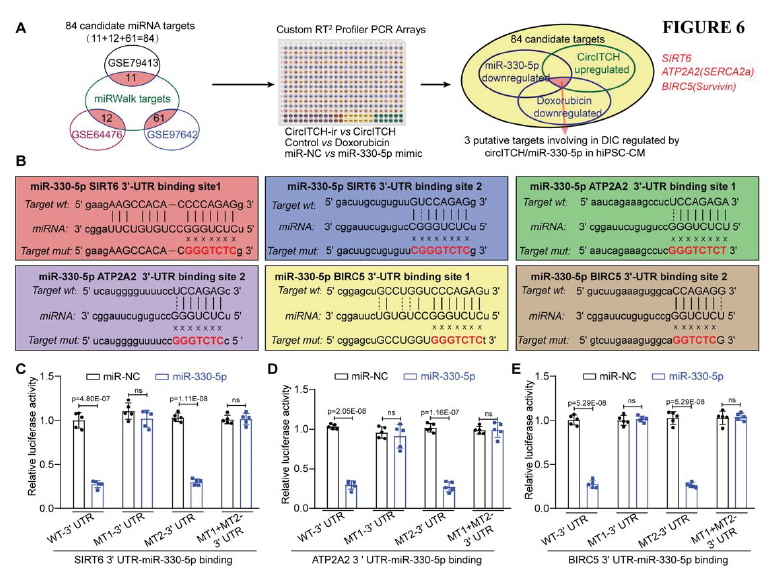
圖6 在DOX處理的hiPSC-CMs中,miR-330-5p直接作用于SIRT6、BIRC5和ATP2A2
7、CircITCH改善小鼠DOXIC
為了在體內進一步驗證CircITCH是否參與DOXIC調節,使用AAV9載體系統在小鼠中過表達CircITCH。過表達效率如圖7B所示。在急性小鼠模型中,HE染色觀察到CircITCH的過表達減少了DOX誘導的心室組織廣泛空泡化(Fig. 7C, D)。提示心肌損傷的心肌酶研究顯示,CircITCH過表達有效地降低了DOX誘導的血清天冬氨酸轉氨酶(AST)、LDH和肌酸激酶(肌/腦)水平(Fig. 7E-G)。此外,功能性心肌研究顯示,包括超聲心動圖和侵入性血流動力學方法,證明CircITCH過表達顯著提高了由阿霉素誘導降低的左心室射血分數(LVEF)、左心室部分縮短(LVFS),左心室收縮末期和舒張末期壓力(LVESP)和一階導數的LV壓力,但過表達降低了DOX引起的左心室舒張末期壓力(LVEDP)的升高(Fig. 7H-O)。這些結果表明CircITCH在小鼠體內同樣具有保護免受DOXIC傷害的作用。
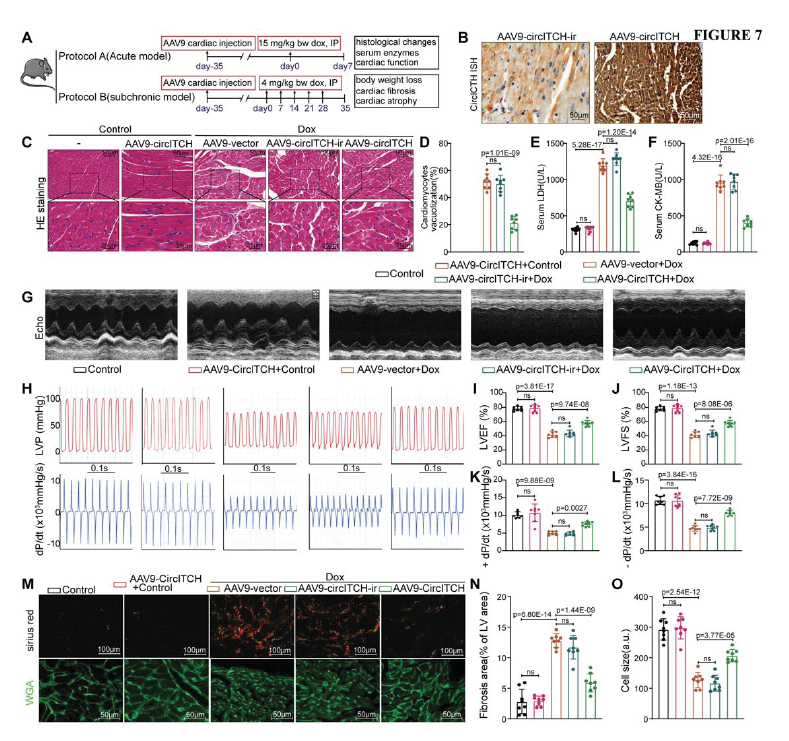
圖7 AAV9介導的CircITCH過表達可改善小鼠DOXIC
總之,如圖8所示,CircITCH發揮其潛在功能,作為ceRNA來吸附miR-330-5p,從而激活miR-330-5p靶標SIRT6,BIRC5(Survivin)和ATP2A2(SERCA2a),從而通過改善DOXIC通過減少氧化壓力和DNA損傷,細胞死亡,收縮功能障礙和鈣處理缺陷。
此外,CircITCH被證實是各種實體瘤中的抑癌劑(右上)。 因此,本文揭示了CircITCH在DOXIC進展中的新作用,并將其確定為促進基于阿霉素的化學療法的有希望的治療劑。 因此,CircITCH具有一箭雙雕的作用,即增強腫瘤抑制作用,同時降低化學療法的心臟毒性。
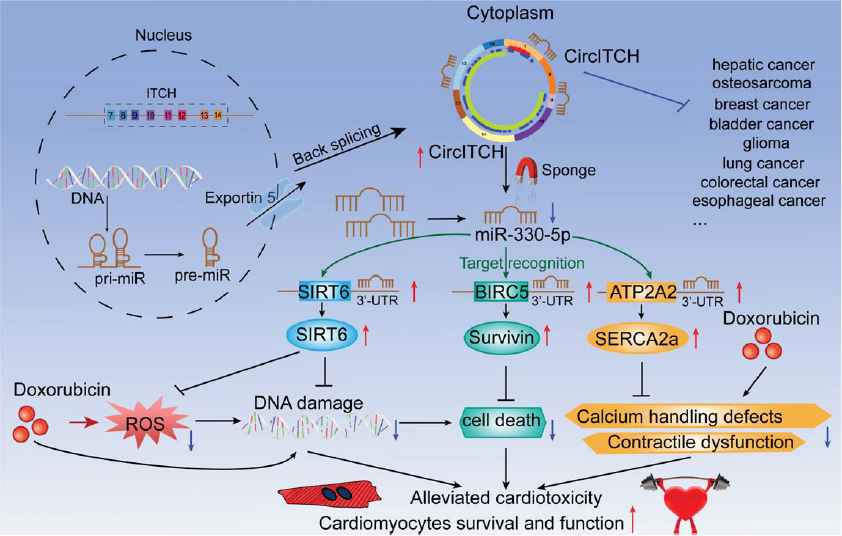
圖8 假設示意圖
參考文獻:
Han Dong., Wang Yongjun., Zhang Jibin., Dai Xinchun., Zhou Tingwen., Chen Jiangwei., Tao Bo., Wang Yabin., Cao Feng.(2020). The Tumor-Suppressive Human Circular RNA CircITCH Sponges miR-330-5p to Ameliorate Doxorubicin-Induced Cardiotoxicity Through Upregulating SIRT6, Survivin, and SERCA2a. Circ. Res., undefined(undefined), undefined. doi:10.1161/CIRCRESAHA.119.316061






