lncRNA EMS 將c-Myc和細胞周期調控以及腫瘤發(fā)生聯系在一起
導語:
c-Myc的表達失調是癌癥的重要分子標志。 c-Myc的致癌功能很大程度上歸因于其作為主要轉錄因子的內在本質。 在這里,將報告一種長鏈非編碼RNA(lncRNA)E2F1信使RNA(mRNA)穩(wěn)定因子(EMS)作為c-Myc的直接轉錄目標。 EMS通過促進G1 / S細胞周期進程而充當致癌分子。 從機理上講,EMS與RNA結合蛋白RALY協同作用來穩(wěn)定E2F1 mRNA,從而增加E2F1的表達。此外,EMS能夠通過調節(jié)E2F1 mRNA的穩(wěn)定性將c-Myc連接到細胞周期控制和腫瘤發(fā)生。 總而言之,這些發(fā)現揭示了一種未發(fā)現的機制,即c-Myc誘導E2F1表達的機制,也暗示EMS是調節(jié)c-Myc功能的重要參與者。
技術路線:
1、使用癌癥基因組圖譜(TCGA)數據庫分析找出具有致癌功能的c-Myc反應性lncRNA
2、通過實時RT-PCR或Western印跡分析驗證了成功的慢病毒介導的敲低和過表達。
3、ASO的轉染,實時RT-PCR,5′ RACE and 3′ RACE. 5
4、RNA原位雜交確定EMS,RNA在細胞中的分布
5、合成EMS及其反義RNA進行體外轉錄
6、生物素下拉檢查EMS和RALY裂解物之間的相互作用
7、ChIP分析、異種移植小鼠模型、
研究結果:1.EMS通過促進G / S細胞周期進程而充當致癌lncRNA使用TCGA數據庫分析, ENCODE c-Myc染色質免疫沉淀測序(ChIP-seq)數據集的分析表明EMS為分子大小為1,098 nt的RNA轉錄本,主要位于細胞質中。數據表明EMS促進細胞增殖。確定了EMS促進細胞增殖并評估了EMS對細胞周期分布的影響。后面證明了EMS通過加速G1 / S細胞周期進程來促進細胞增殖。再進行了軟瓊脂菌落形成試驗、異種移植小鼠模型,顯示出EMS基因敲低可強烈抑制A549細胞的體內異種移植腫瘤生長。TCGA數據庫的分析,LUAD,LUSC,COAD和乳腺浸潤性癌(BRCA)中的EMS表達水平升高。此外,腫瘤細胞系A549,PC9和H1299具有更高的EMS拷貝數。
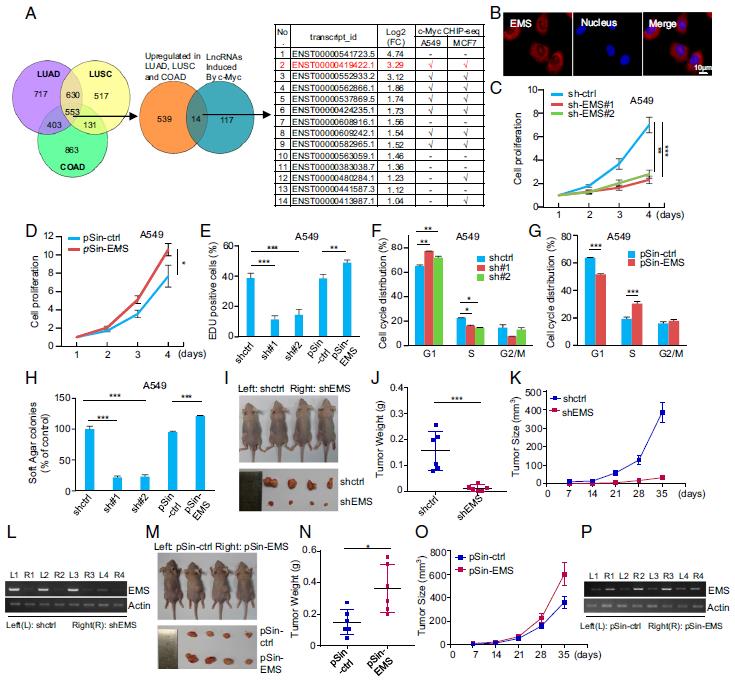
2 .EMS是c-Myc的直接轉錄目標
通過RNA測序分析,EMS被鑒定為c-Myc反應性lncRNA。證明c-Myc的誘導增加,而c-Myc的敲低減少,A549,PC9,H1299,HCT116和MCF7細胞中的EMS表達,表明c-Myc對EMS表達的特異性作用。根據c-Myc和EMS細胞表達之間的關系,對TCGA數據庫的分析表明,c-Myc和EMS的表達水平在LUAD,LUSC,COAD和BRCA中呈正相關。接下來,使用JASPAR數據庫檢查EMS基因的上游和內含子區(qū)域(43)。確定了三個推定的c-Myc結合位點(D1,D2和D3。此外,對ENCODE ChIP-seq數據集的分析表明,在EMS的轉錄起始位點周圍存在c-Myc和活性組蛋白標記H3K4me3。 ChIP分析驗證了c-Myc與包含D2位點的染色質片段的相互作用。使用了基于pGL3的熒光素酶報告基因構建表明EMS受c-Myc轉錄調控。
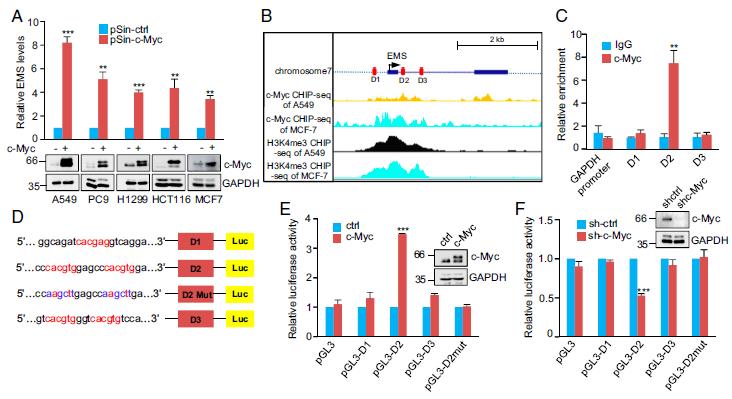
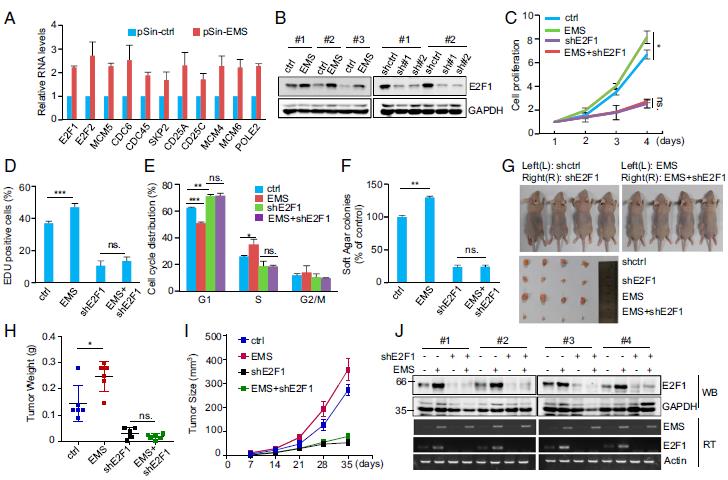
3.MS通過增加E2F1表達發(fā)揮其致癌作用
EMS的敲低或過表達均未顯示影響IFT22和lncPRESS1的表達水平。基因表達譜分析。敲出EMS導致987個基因的差異表達。基因集富集分析表明, E2F目標顯著富集。EMS對E2F1通路產生積極影響,對EMS過表達和敲低細胞中E2F1及其靶基因mRNA表達的積極影響。另外,EMS的異位表達增加,而EMS的敲低降低了E2F1的蛋白質水平。TCGA數據庫分析表明,EMS和E2F1的表達水平在LUAD,LUSC,COAD和BRCA中呈正相關。這些數據表明,EMS能夠積極調節(jié)E2F1表達。EMS加速了G1 / S細胞周期的進展。通過使用異種移植小鼠模型,發(fā)現EMS促進了裸鼠的異種移植腫瘤生長。通過E2F1誘導可以極大地恢復EMS抑制性抑制異種移植瘤的生長。綜上所述,這些發(fā)現表明EMS通過增加E2F1表達發(fā)揮其致癌作用。
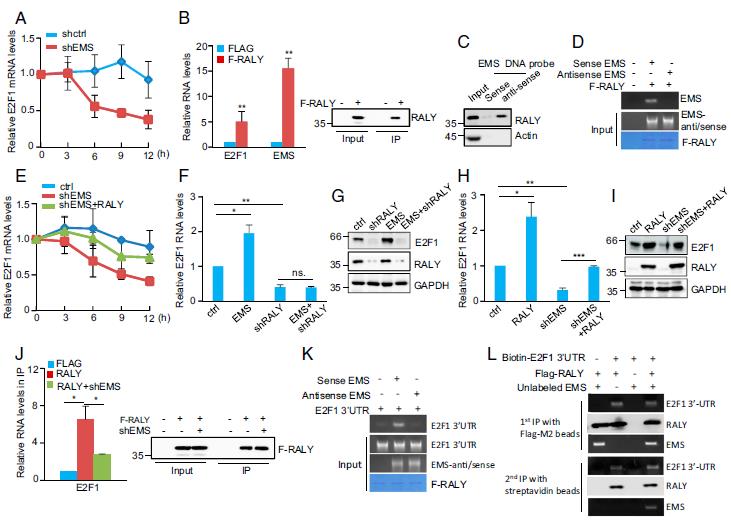
4.EMS與RALY合作提高E2F1 mRNA的穩(wěn)定性
用actinomycinD處理具有擊倒或EMS過度表達的A549細胞不同時間,以測量E2F1 mRNA的衰減。擊倒EMS會導致E2F1 mRNA的半衰期減少,而EMS的過表達會延長E2F1 mRNA的半衰期,表明EMS可以穩(wěn)定E2F1 mRNA。lncRNA H19確實存在于Ago2免疫沉淀物中。與H19不同,EMS沒有富含Ago2免疫沉淀物。對EMS序列的分析表明,EMS包含具有22個尿苷的聚U區(qū)段,表明RALY也可能與EMS相互作用。進RNA免疫沉淀實驗,EMS確實富集了Flag-RALY免疫沉淀。通過生物素下拉測定法也驗證了RALY-EMS的相互作用。此外,體外結合試驗表明,RALY與EMS直接相互作用,但不與它的反義RNA相互作用。證明RALY是EMS的交互合作伙伴,RALY-EMS的相互作用,RALY與EMS直接相互作用,但不與它的反義RNA相互作用。與野生型EMS相比,缺失22個尿苷的突變EMS(EMS-ΔpolyU)顯示出與RALY的結合減少,證明RALY是EMS的交互合作伙伴。綜上所述,這些數據表明EMS與RALY合作以促進E2F1 mRNA的穩(wěn)定性。
5. EMS通過RALY調節(jié)腫瘤細胞的生長
評估EMS是否通過RALY調節(jié)腫瘤細胞的生長。RALY的敲除作用大大降低,而RALY的過表達則顯著增加,細胞增殖,Edu陽性細胞數量和錨定依賴性細胞生長。EMS通過RALY促進了腫瘤細胞的生長。EMS敲除對細胞增殖的抑制作用包括:異位表達的RALY可以大大逆轉Edu陽性細胞的數量,以及與錨定無關的細胞的生長。接下來,證明 EMS的異位表達顯示可加速G1 / S細胞周期的敲低細胞。此外,EMS敲低抑制的G1 / S細胞周期進程被RALY過表達顯著逆轉。這些數據表明EMS通過RALY調節(jié)腫瘤細胞的生長。
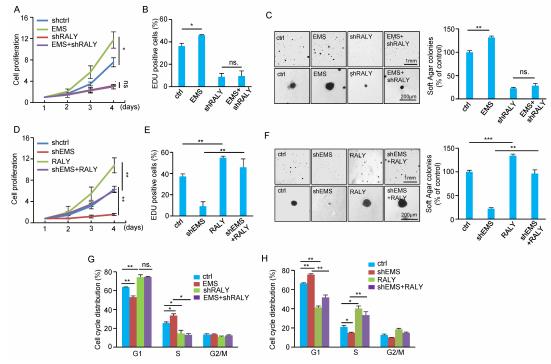
6. EMS將c-Myc連接到細胞周期控制和腫瘤發(fā)生
通過實驗數據表明c-Myc 通過促進EMS介導的E2F1 mRNA穩(wěn)定來調節(jié)E2F1表達。c-Myc的異位表達增強了細胞增殖,并增加了對照細胞中的正向陽性細胞的數量。細胞周期分布的分析表明,c-Myc加速的G1 / S細胞周期進程可以通過同時進行的EMS抑制來逆轉。這些數據表明,c-Myc可通過促進EMS介導的G1 / S細胞周期進程來增加腫瘤細胞的生長。通過進行軟瓊脂菌落形成試驗,顯示c-Myc的異位表達僅能促進對照細胞中錨定非依賴性細胞的生長,而不能促進EMS抑制細胞的生長。通過使用異種移植小鼠模型,A549細胞中異位表達的c-Myc有望顯著提高異種移植腫瘤的生長。表明c-Myc可能通過EMS促進了腫瘤的生長。通過EMS抑制可將c-Myc對異種移植瘤生長的促進作用最小化。綜上所述,這些數據表明,EMS通過調節(jié)E2F1 mRNA的穩(wěn)定性將c-Myc連接到細胞周期控制和腫瘤發(fā)生。
總結 :
作為最重要的癌基因之一,c-Myc在一半以上的人類癌癥中被激活。 c-Myc的致癌功能很大程度上歸因于其作為主要轉錄因子的內在本質。長非編碼RNA(lncRNA)的失調與多種人類疾病有關,包括癌癥。 然而,lncRNA在調節(jié)c-Myc致癌活性中的功能中具有重要作用。作者發(fā)現作為c-Myc的轉錄靶標,lncRNA E2F1信使RNA(mRNA)穩(wěn)定因子通過調節(jié)E2F1 mRNA的穩(wěn)定性來調節(jié)c-Myc功能。這項研究提供了有關c-Myc促進腫瘤發(fā)生機制的見解。






