癌癥中的代謝和表觀遺傳學之間的聯系
在過去十年中,在癌細胞代謝領域進行的研究揭示了代謝改變和癌癥進展之間的新聯系。眾所周知,癌細胞在腫瘤發生和轉移的過程中會改變其代謝結構,從而表現出嚴格調控的代謝可塑性程序。值得注意的是,某些代謝改變發生在表觀遺傳水平,從而使表觀遺傳學和代謝高度交織在一起。
在這里,我們討論了癌癥細胞代謝的最新發現,闡明了維持癌癥生長所需的主要合成代謝、分解代謝和能量需求,以及代謝改變對表觀遺傳學的影響。

1. 癌癥代謝
1.1有氧糖酵解
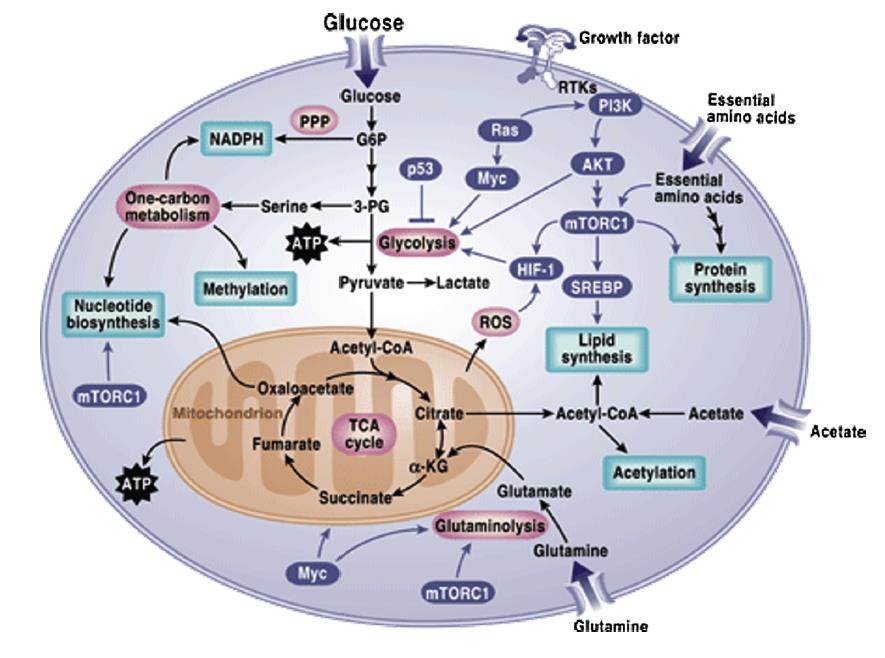
糖酵解是將葡萄糖轉化為PEP的代謝途徑。1920年,Otto Heinrich Warburg觀察到,即使在富含氧氣的情況下,癌細胞的糖酵解也會增強。眾所周知,糖酵解在厭氧條件下通常會增加,糖酵解在癌細胞中的增加是一個相當新的現象,被稱為有氧糖酵解或瓦氏效應。因此,葡萄糖分解代謝為乳酸的高速率代表了在癌細胞中觀察到的最普遍的代謝表型,同時導致乳酸副產品在腫瘤微環境中積累。在癌細胞中,瓦氏效應并不是一個產生能量的途徑,而是一種產生糖酵解和生物合成中間體的模式,并作為許多其他合成代謝過程的前體,重新合成碳水化合物、核酸、蛋白質和脂肪,從而促進癌細胞的生存和生長。
1.2戊糖磷酸途徑
與糖酵解平行的代謝途徑是戊糖磷酸途徑。它是一種合成代謝途徑,產生NADPH,5-碳糖,即戊糖和核糖5-磷酸。這一途徑對于幫助癌細胞滿足其合成代謝的需求,并在氧化和營養脅迫下存活是至關重要的。
1.3 PI3K通路
PI3K通路的激活在腫瘤細胞中經常被發現。PI3K的激活進一步導致AKT的激活,AKT是一種促生存激酶。AKT被認為是葡萄糖攝取的主要調控因子,通過糖酵解和PPP促進葡萄糖代謝。此外,它在癌細胞中驅動Warburg效應,從而使葡萄糖進入糖酵解途徑。
1.4 氧化還原平衡
細胞代謝也產生一些有毒的副產品。其中ROS增加時對蛋白質、脂類和核苷酸具有明顯的損傷作用。癌細胞采用了一種獨特的機制來解毒ROS,即谷胱甘肽氧化還原作用與NADPH還原氧化作用。值得注意的是,NADPH水平升高是癌細胞的一個共同特征,這有助于它們對抗過多的ROS,并通過支持合成代謝途徑幫助它們存活。
1.5 谷氨酰胺
谷氨酰胺是癌細胞中利用最迅速的氨基酸。體外實驗表明,在培養基中,癌細胞的存活需要較高水平的谷氨酰胺。谷氨酰胺能夠提供乙酰輔酶a作為支持腫瘤細胞生長的大分子生物合成的前體。研究發現,含有激活RAS基因突變的細胞對谷氨酰胺的吸收增加導致產生谷胱甘肽,以應對氧化應激。圖1總結了調控癌癥代謝的信號級聯。
2. 癌癥中代謝和表觀遺傳學的相互作用
2.1表觀遺傳學和癌癥代謝
已知癌癥代謝至少通過三種不同的細胞機制影響細胞的表觀遺傳結構。首先是代謝途徑的重新編程。這種重新編程導致代謝產物水平的改變。某些代謝物是表觀遺傳修飾關鍵酶的重要輔助因子或底物。第二種機制與代謝酶轉移到細胞核產生代謝物有關。最后,是調節幾種強效表觀遺傳酶活性的代謝產物的產生。
眾所周知,基因表達的表觀遺傳調控發生在DNA、組蛋白和RNA水平。在此背景下,DNA甲基化、組蛋白甲基化、乙酰化、泛素化、磷酸化和基因沉默已被很好地表征。異常的DNA甲基化與多種人類癌癥的病理基因表達有關。全局DNA低甲基化和位點特異性CpG啟動子高甲基化是癌癥中最常見的表觀遺傳學改變。
2.2 DNA/組蛋白甲基化的代謝控制
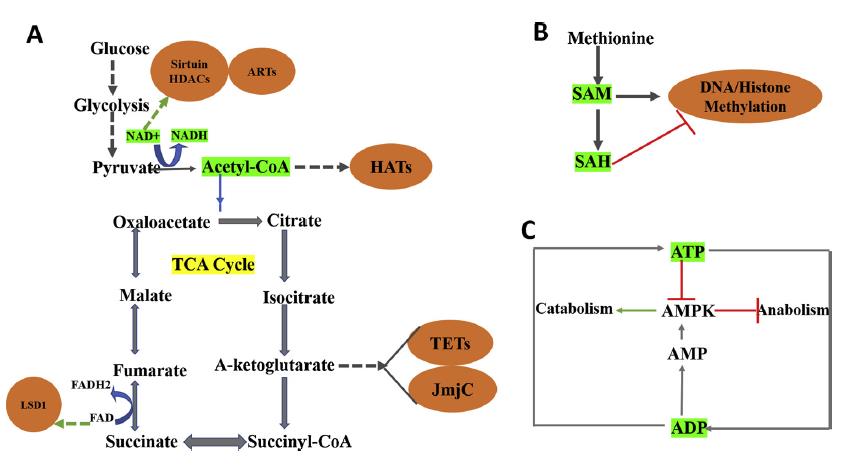
由蛋氨酸和ATP合成的s -腺苷蛋氨酸(SAM)是哺乳動物中普遍存在的甲基供體。DNA的甲基化是由使用SAM作為甲基供體的DNA甲基轉移酶(DNMT)介導的。組蛋白的甲基化也需要SAM,當甲基化發生在賴氨酸或精氨酸殘基時,反應由組蛋白甲基轉移酶(HMT)催化。因此,SAM的豐度或有效性直接影響DNA和組蛋白的甲基化狀態。
相反,DNA和組蛋白去甲基化酶的去甲基化活性會引起DNA和組蛋白甲基化事件的逆轉。組蛋白去甲基酶分為兩組:賴氨酸特異性去甲基酶家族和含有Jmjc的家族蛋白,均為黃素腺嘌呤二核苷酸依賴的氧化酶。JmjC家族去甲基酶是一種亞鐵離子依賴的氧合酶,使用a-酮戊二酸酯(aKG)作為酶激活的輔助因子。值得注意的是,催化輔助因子FAD和αKG由TCA代謝途徑生成。同樣,DNA 去甲基化酶TET家族蛋白的激活也需要FAD和aKG。相比之下,其他TCA循環代謝物,包括琥珀酸和富馬酸,則作為JmjC家族去甲基酶的拮抗劑。因此線粒體中的TCA代謝途徑可以直接參與基因組的表觀遺傳調控。
組蛋白乙酰化是另一種重要的表觀遺傳機制,它參與了DNA復制、損傷等染色質依賴過程修復,轉錄激活,細胞周期和基因調控。兩類酶參與組蛋白乙酰化的動態調控,分別是組蛋白乙酰轉移酶(HAT)和組蛋白去乙酰化酶(HDAC)。乙酰輔酶a是通過氧化磷酸化和輔助合成代謝過程產生能量的關鍵代謝產物之一。有趣的是,乙酰輔酶a作為HATs的底物,HATs將乙酰輔酶a的乙酰基轉移到組蛋白的賴氨酸殘基上。這種反應主要與轉錄激活有關,對癌細胞等快速增殖細胞至關重要。因此,細胞乙酰輔酶a水平的變化密切影響HAT介導的組蛋白乙酰化。
同樣地,組蛋白乙酰化的逆轉是由一組稱為HDACs的酶進行的。他們從組蛋白賴氨酸殘基上除去乙酰基。這導致組蛋白緊密包裹DNA,因此功能與帽子相反。細胞內乙酰化水平歸因于HAT和HDAC活性之間的精細平衡。不同的細胞代謝物拮抗HDACs的活性。其中butyrate是一種強效拮抗劑,可抑制HDACs I、II和IV的活性。butyrate是由菌落細菌產生的,菌落細菌主要發酵膳食纖維。腫瘤的代謝,如糖酵解增加乳酸的產生,有助于腫瘤微環境中局部酸性pH值的生成。已知這種情況可促進組蛋白去乙酰化。有趣的是,這種情況有利于癌細胞的侵襲性、前轉移表型。此外,低組蛋白乙酰化水平與癌癥患者較差的預后相關。另一種代謝物NAD+作為HDAC III介導的組蛋白去乙酰化反應的催化輔因子。總結的概念如圖2所示。
2.3癌癥代謝酶的遺傳和表觀遺傳改變
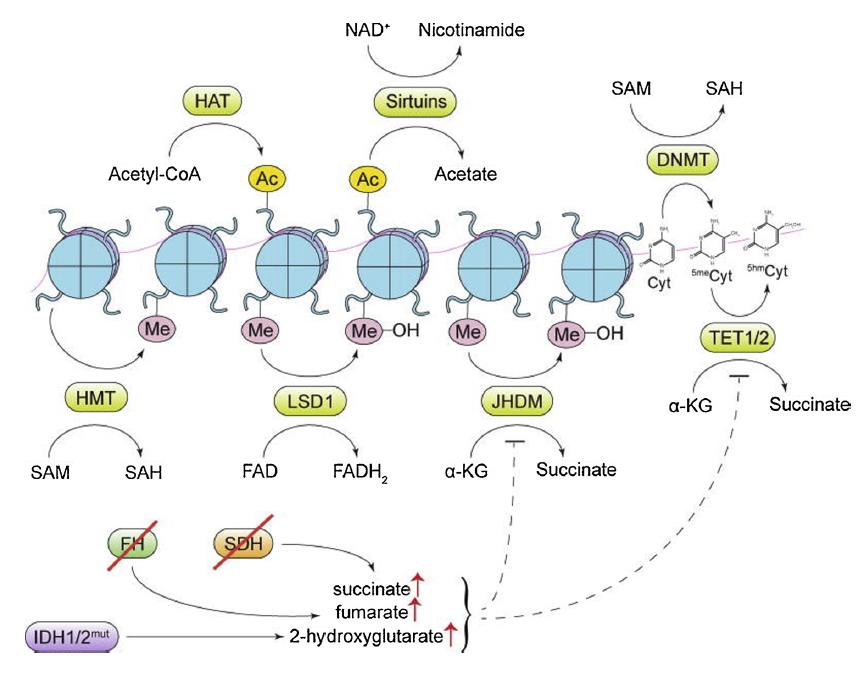
幾項研究表明,代謝酶的突變使細胞發生腫瘤。這些突變促進了癌代謝物的產生,最終影響DNA和組蛋白的表觀遺傳學調控。NADP+依賴的異檸檬酸脫氫酶(IDH1和IDH2)、琥珀酸脫氫酶(SDH)和延胡索酸水合酶(FH)突變頻繁。這些代謝酶的失活突變導致2-羥基戊二酸鹽、琥珀酸鹽和富馬酸鹽分別堆積。這些突變具有致癌性質,琥珀酸和富馬酸都抑制TET和Jmj-C家族蛋白的酶活性。攜帶IDH1/IDH2突變的癌細胞表現出DNA和組蛋白的高甲基化。膠質瘤和血癌經常在IDH1和IDH2中表現出致癌突變。煙酰胺n -甲基轉移酶(NNMT)是另一種代謝酶,催化甲基部分從SAM轉移到煙酰胺,從而將SAM分解代謝為1-甲基煙酰胺(1MNA),在多種癌癥中異常表達,與增強遷移和侵襲行為有關。過度表達NNMT的癌細胞表現出SAM和組蛋白甲基化水平的改變,同時獲得了更具侵略性的表型。NNMT催化的反應阻礙了SAM介導的DNA和組蛋白甲基化過程。整個過程如圖3所示。
除了基因突變外,表觀遺傳事件也有助于癌癥代謝酶的改變。這種代謝酶的例子包括己糖激酶亞型2 (HK2)和果糖-1,6-雙磷酸酶(FBP1)。啟動子低甲基化等表觀遺傳事件是膠質母細胞瘤和肝癌中HK2上調的原因。啟動子甲基化導致胃癌、肝癌和結腸癌組織中FBP1的沉默。雖然增加HK2水平有助于增強糖酵解通量,但在癌細胞中糖異生受FBP1調控。
3. 靶向代謝治療癌癥
近年來,癌癥藥物發現領域的進展集中在癌細胞利用的幾種有效代謝途徑的抑制劑上。抑制某些關鍵代謝酶的活性具有很大的潛力。以糖酵解、線粒體代謝、谷氨酸代謝和自噬等與癌細胞存活和進展有關的代謝途徑為靶點,為新藥物發現提供了有效的策略。






